
已知:N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法。请回答下列问题:
2NH3(g)△H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法。请回答下列问题:
(1)450℃时,往一个2L的密闭容器中充入2. 6mol H2和1mol N2, 反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
|
时间/min |
5 |
10 |
15 |
20 |
25 |
30 |
|
c(NH3)/mol·L—1 |
0.08 |
0.14 |
0.18 |
0.20 |
0.20 |
0.20 |
①5 min内,消耗N2的平均反应速率为_______________,此条件下该反应的化学平衡常数K=_______________;反应达到平衡后,若往平衡体系中加入H2、N2和NH3各2mol,此时该反应的v(N2)正_______________v(N2)逆(填写“>”、“=”或“<”=)。
②下列各项能作为判断该反应达到化学平衡状态的依据是__________(填序号字母)
A.容器内N2、H2、NH3的浓度之比为1:3:2
B.v(N2)正=3v(H2)逆 C.容器内压强保持不变
D.混合气体的密度保持不变 E.容器内混合气体的平均分子量不变
③若改变某一条件,达新平衡时n(H2)=1.60mol ,下列说法正确的是_____________。
A.平衡一定正向移动 B.可能是向容器中加入了一定量的H2气体
C.可能是降低了容器的温度 D.可能是缩小了容器的体积
(2)450℃时,在另一密闭容器中进行上述合成氨的反应,各物质的起始浓度和平衡浓度如下表所示:
|
|
N2 |
H2 |
NH3 |
|
起始浓度(mol/L) |
0.2 |
0.3 |
0.2 |
|
平衡浓度(mol/L) |
a |
b |
c |
请回答:
①各物质的平衡浓度可能是_______________.
A.c=0.5mol/L B.b=0.5mol/L C.c=0.4mol/L D.a=0.3mol/L
②a的取值范围是:_______________.
③请用数学表达式表示下列量之间的关系:
(I)a与b的关系:_______________。
(Ⅱ)a、b、c的关系:_______________。
(3) 根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水可发生下列反应:2N2(g)+6H2O(l)  4NH3(g)+3O2(g),此反应的△S__________0(填“
4NH3(g)+3O2(g),此反应的△S__________0(填“ ”、 “
”、 “ ”或“=”), △H=_____________。
”或“=”), △H=_____________。
(已知:H2的燃烧热为285.8 kJ/mol)
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 在一定温度下,向容积不变的容器中加入2mol N2、8mol H2及固体催化剂,使之反应.已知:N2(g)+3H2(g)?2NH3(g);△H=-92.2kJ?mol-1.平衡时,容器内气体压强为起始时的80%.
在一定温度下,向容积不变的容器中加入2mol N2、8mol H2及固体催化剂,使之反应.已知:N2(g)+3H2(g)?2NH3(g);△H=-92.2kJ?mol-1.平衡时,容器内气体压强为起始时的80%.

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 9N2(g)+6CO2(g)+6H2O(g);
9N2(g)+6CO2(g)+6H2O(g); 9N2(g)+12CO2(g)+12H2O(g);
9N2(g)+12CO2(g)+12H2O(g);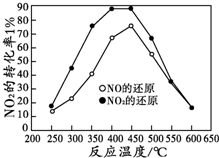
 O2+Hb?CO K=220
O2+Hb?CO K=220查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 氨气是一种重要的化工原料,但随着工业化进程的加快,氨气也逐渐变成居室里一种重要的污染性气体.
氨气是一种重要的化工原料,但随着工业化进程的加快,氨气也逐渐变成居室里一种重要的污染性气体.
| ||
| ||
| C2(NH3)?C(CO2) |
| C(H2O) |
| C2(NH3)?C(CO2) |
| C(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 目前,全国多个地区为雾霾所困,氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.
目前,全国多个地区为雾霾所困,氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com