
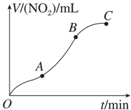
| A. | OA段表示开始时,反应速率稍慢 | |
| B. | AB段表示反应速率较快,一定因为产物有催化作用 | |
| C. | BC段表示随时间增加,反应速率逐渐增大 | |
| D. | BC段表示反应速率最快,在该时间段内收集到的气体最多 |
分析 由图象可知,曲线斜率越大,反应速率越快,开始温度较低,反应较缓慢,后来Cu变疏松,接触面积增大,且该反应为放热反应,反应速率加快,后来离子浓度减小,反应速率减小,以此来解答.
解答 解:A.OA段表示开始时,由图象可知曲线斜率不大,反应速率稍慢,故A正确;
B.AB段表示反应速率较快,与Cu的接触面积和温度有关,故B错误;
C.由曲线斜率可知BC段速率较小,故C错误;
D.由图象可知AB段曲线斜率最大表示反应速率最快,向纵坐标作辅助线可知在该时间段内收集到的气体最多,故D错误;
故选A.
点评 本题考查影响化学反应速率的因素,注意把握图象中反应速率的变化及浓度、温度对反应速率的影响即可解答,注重基础知识的考查,题目难度不大.


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源:2017届云南省高三上第二次周考化学试卷(解析版) 题型:选择题
用NA代表阿伏伽德罗常数,下列说法正确的是
A.46克NO2和N2O4混合气体中所含原子数为3NA
B.标准状况下,11.2LCH2Cl2所含的分子数为0.5NA
C.0.5NA氖气分子中含有氖原子1NA
D.25℃时,pH=13的1L硫酸溶液中含有H+的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体和溶液的本质区别是胶体可以发生丁达尔现象 | |
| B. | 0.1molFeCl3溶于水中形成胶体后含有胶体粒子的数目为0.1NA | |
| C. | 明矾净水与胶体的性质有关 | |
| D. | 可以用滤纸分离提纯胶体和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②④ | C. | ①③ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯分子的比例模型: | B. | HF的电子式:H:F | ||
| C. | Cl-离子的结构示意图: | D. | NH4Cl的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MFe2Ox中铁元素的化合价一定为+2 | B. | 320gMFe2Ox的物质的量小于2mol | ||
| C. | 1molMFe2Ox中Fe的物质的量为112g | D. | 1molMFe2Ox的体积为22.4L |
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上第二次适应性考试化学卷(解析版) 题型:实验题
Na2O2可用作漂白剂和呼吸面具中的供氧剂。
(1)某学习小组发现:在盛有Na2O2的试管中加入足量水,固体完全溶解,并立即产生大量气泡,当气泡消失后,向其中滴入1~2滴酚酞溶液,溶液变红;将试管轻轻振荡,红色很快褪去;此时再向试管中加入少量MnO2粉末,又有气泡产生。
①使酚酞溶液变红是因为__________,红色褪去的可能原因是__________________。
②加入MnO2反应的化学方程式为__________________________。
(2)Na2O2有强氧化性,H2具有还原性,有同学猜想Na2O2与H2能反应。为了验证此猜想,该小组同学进行如下实验,实验步骤和现象如下。
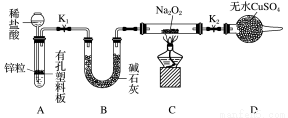
步骤1:按上图组装仪器(图中夹持仪器省略),检查气密性,装入药品。
步骤2:打开K1、K2,产生的氢气流经装有Na2O2的硬质玻璃管,一段时间后,没有任何现象。
步骤3:检验H2的纯度后,开始加热,观察到硬质玻璃管内Na2O2开始熔化,淡黄色的粉末变成了白色固体,干燥管内硫酸铜未变蓝色。
步骤4:反应后撤去酒精灯,待硬质玻璃管冷却后关闭K1。
①添加稀盐酸的仪器名称是____________;B装置的作用是________。
②必须检验氢气纯度的原因是_____________________。
③设置装置D的目的是___________________________。
④你得到的结论是____________(若能反应请用化学方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com