
| A. | 1/22.4mol/L | B. | V/33.6mol/L | C. | V/22.4mol/L | D. | 1/33.6mol/L |
分析 氨气溶于水,溶液体积等于氨气体积,圆底烧瓶的容积为VL,则氨气和溶液的体积为VL,根据n=$\frac{V}{{V}_{m}}$计算氨气的物质的量,再根据c=$\frac{n}{V}$计算溶液的物质的量浓度.
解答 解:氨气极易溶于水,圆底烧瓶的容积为VL,则氨气和溶液的体积为VL,
标况下VL氨气的物质的量为:$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,
所得溶液的物质的量浓度为:c=$\frac{\frac{V}{22.4}mol}{VL}$=$\frac{1}{22.4}$mol/L,
故选A.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量浓度的概念及表达式为解答关键,试题培养了学生的分析能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径/10-10 m | 0.66 | 1.36 | 1.23 | 1.10 | 0.99 | 1.54 | 0.70 | 1.18 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
| A. | 最高价氧化物的水化物酸性:④>⑤ | B. | 与水反应的剧烈程度:②>⑥ | ||
| C. | 气态氢化物的稳定性:④>⑦ | D. | ①⑥⑦形成的化合物是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将大小、形状相同的镁条和铝条与相同浓度、相同温度下的盐酸反应时,两者快慢相同 | |
| B. | 盛有相同浓度双氧水的两支试管,一支加入MnO2放在冷水中,一支直接放在冷水中,前者反应快 | |
| C. | 将浓硝酸分别放在冷暗处和强光下,发现强光下的浓硝酸分解得快 | |
| D. | 升高温度,H2O2的分解速率加快,原因是反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水和碘化钾反应:Cl2+2I-=2Cl-+I2 | |
| B. | 盐酸与AgNO3溶液反应:HCl+Ag+=H++Ag Cl↓ | |
| C. | 氢氧化钙溶液吸收氯气:Cl2+2OH-=Cl-+ClO-+H2O | |
| D. | 二氧化锰和盐酸制氯气:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将LiCoO2改写成为氧化物的形式为Li2O•Co2O3 | |
| B. | 该电池的电解液必须使用有机溶剂主要是由于有机溶剂有良好的导电性 | |
| C. | Li是3号元素,是最轻的金属之一,这类电池质能比高 | |
| D. | 在电池充放电时,Li+在两个电极之间往返嵌入和脱嵌.该电池的充放电反应方程式为:LiCoO2+6C$?_{放电}^{充电}$Li1-xCoO2+LixC6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
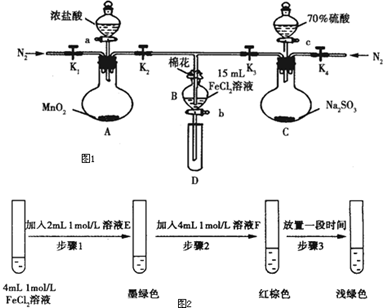
| 过程Ⅳ:B溶液中含有的离子 | 过程Ⅵ:B溶液中含有的离子 | |
| 甲 | 有Fe3+,无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+、又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+、无Fe2+ | 有Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com