
| A. | 用NaOH溶液滴定CH3COOH溶液,可选用甲基橙作指示剂 | |
| B. | 用量筒量20mL0.5000mol•L-1H2SO4溶液于烧杯中,加水80mL,配制成0.1000mol•L-1H2SO4溶液 | |
| C. | 常温下,物质的量浓度均为0.1mol•L-1的盐酸、醋酸溶液,分别用水稀释100倍后pH的关系为:盐酸>醋酸 | |
| D. | 实验室常将氯化铁先溶于盐酸,再加水稀释来配制其溶液 |
分析 A.氢氧化钠和醋酸反应恰好反应生成的盐是强碱弱酸盐,盐水解显碱性,应选择碱性条件下变色的指示剂;
B.配制一定物质的量浓度溶液需要用容量瓶;
C.醋酸是弱电解质,部分电离,HCl是强电解质,完全电离;
D.氯化铁是强酸弱碱盐,铁离子水解产生HCl.
解答 解:A.氢氧化钠和醋酸反应恰好反应生成的盐是强碱弱酸盐,盐水解显碱性,应选择碱性条件下变色的指示剂,不能选择甲基橙,应选择酚酞指示剂,故A错误;
B.配制一定物质的量浓度溶液需要用容量瓶,应该先将盐酸在烧杯中稀释,冷却至室温后,再转移到容量瓶中来配制溶液,故B错误;
C.醋酸是弱电解质,部分电离,HCl是强电解质,完全电离,常温下稀释相同物质的量浓度的醋酸和盐酸,稀释相同倍数时醋酸中氢离子浓度小于盐酸,则溶液的pH:醋酸>盐酸,故C错误;
D.氯化铁是强酸弱碱盐,铁离子水解产生HCl,为了防止氯化铁水解,则实验室常将氯化铁先溶于盐酸,再加水稀释来配制其溶液,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及盐类水解、弱电解质的电离、溶液配制、酸碱中和滴定等知识点,明确实验原理、物质性质及实验基本操作是解本题关键,易错选项是A,注意酸碱指示剂的选取方法,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题

| A. | 石墨电极上产生氢气 | |
| B. | 铜电极被还原 | |
| C. | 铜电极接直流电源的负极 | |
| D. | 当有1 mol电子转移时,有1 mol Cu2O生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④③②① | B. | ①④②③ | C. | ③①④② | D. | ①④③② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
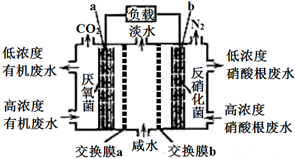
| A. | 电池工作时,电子由a极经导线流向b极 | |
| B. | 交换膜a是阴离子交换膜 | |
| C. | 电极b的反应式:2NO3-+10e-+6H2O=N2↑+12OH- | |
| D. | 相同时间内(相同状况下)生成CO2和N2的体积比为5:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
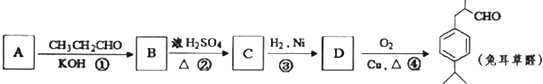
 可写成
可写成
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
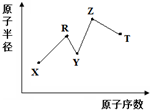 现有短周期主族元素X、Y、Z、R、T,R原子的最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Y与T同主族.五种元素原子半径与原子序数之间的关系如图所示.下列推断正确的是( )
现有短周期主族元素X、Y、Z、R、T,R原子的最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Y与T同主族.五种元素原子半径与原子序数之间的关系如图所示.下列推断正确的是( )| A. | 离子半径:Y<Z | |
| B. | 氢化物的沸点:Y<T | |
| C. | 最高价氧化物对应水化物的酸性:T<R | |
| D. | 由X、Y、Z、R四种元素组成的常见化合物中含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 每生成2分子AB吸收bkJ热量 | |
| B. | 该反应热△H=(a-b) kJ•mol-1 | |
| C. | 该反应中反应物的总能量高于生成物的总能量 | |
| D. | 断裂1molA-A键和1molB-B键,放出akJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ①③④⑤ | C. | ②⑥⑦ | D. | ⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com