
| X | ||
| Y | Z | W |
| T |
| A. | Y的最高价氧化物的水化物具有两性 | |
| B. | Z的最高价氧化物常温常压下为固体 | |
| C. | 气态氢化物的稳定性:X>W>Z | |
| D. | 原子半径:W>Z>Y |
分析 X、Y、Z、W为短周期元素,Y的周期数等于其族序数,结合位置可知Y为第三周期第ⅢA族元素,则Y为Al,由图可知,Z为Si,X为N,W为P,T为Ga,
A.Y的最高价氧化物的水化物为氢氧化铝;
B.Z的最高价氧化物为二氧化硅;
C.非金属性越强,对应氢化物越稳定;
D.同周期从左向右原子半径减小.
解答 解:Y为Al,Z为Si,X为N,W为P,T为Ga,
A.Y的最高价氧化物的水化物为氢氧化铝,与强酸、强碱均反应生成盐和水,具有两性,故A正确;
B.Z的最高价氧化物为二氧化硅,常温为固体,故B正确;
C.非金属性X>W>Z,气态氢化物的稳定性:X>W>Z,故C正确;
D.同周期从左向右原子半径减小,则原子半径:Y>Z>W,故D错误;
故选D.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、性质及元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 铝具有强还原性 | 可用铝与浓硫酸反应制备氢气 |
| B | Fe(OH)2稳定 | 用FeCl2溶液和NaOH溶液反应可制取纯净的Fe(OH)2 |
| C | Na2O2与CO2反应生成氧气 | Na2O2可作供氧剂 |
| D | 二氧化硅不与任何酸反应 | 可用二氧化硅制造耐酸容器 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NF3是还原剂,H2O是氧化剂 | |
| B. | N O是还原产物,HNO3是氧化产物 | |
| C. | 在潮湿天气中NF3泄漏常常容易被发现 | |
| D. | 一旦NF3泄漏,可以用石灰水喷淋的方法减少污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2被酸性高锰酸钾吸收:MnO4-+SO2+4H+═Mn2++SO42-+2H2O | |
| B. | 向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| C. | 氯化镁溶液中加入足量浓氨水 Mg2++2NH3•H2O═Mg(OH)2↓+2NH4+ | |
| D. | Fe3O4与稀硝酸的反应:Fe3O4+8H+═Fe2++2Fe3++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
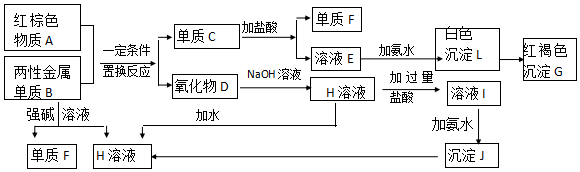
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氯有酸性,氯水也有酸性 | |
| B. | 液氯和氯水都有漂白性 | |
| C. | 液氯是纯净物,而氯水是混合物 | |
| D. | 液氯无色,氯水呈黄绿色,两者均存在氯离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com