
【题目】mg铝镁合金与一定浓度的稀硝酸恰好完全反应(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加amol/LNaOH溶液,当滴加到VmL时,得到沉淀质量恰好为最大值ng,则下列有关该实验的说法中正确的有
①沉淀中氢氧根的质量为(n-m)g
②恰好溶解后溶液中的NO3-离子的物质的量为aVmol
③反应过程中转移的电子的物质的量为![]() mol
mol
④生成NO气体的体积室温下为![]() L
L
⑤与合金反应的硝酸的物质的量为(![]() )mol
)mol
A. 2项 B. 3项 C. 4项 D. 5项
【答案】B
【解析】
镁铝合金与一定浓度的稀硝酸恰好完全溶解,向反应后的混合溶液中滴加amol·L-1NaOH溶液,当滴加到VmL时,得到沉淀质量恰好为最大值,沉淀质量最大时,沉淀Wie氢氧化铝和氢氧化镁,此时溶液为硝酸钠溶液;
①沉淀质量等于合金质量与OH-质量之和;
②根据n(NO3-)=n(NaNO3)=n(NaOH),进行计算;
③沉淀中OH-的物质的量等于Mg2+、Al3+所带电荷的物质的量,也等于合金失去电子物质的量;
④条件是室温状态,不是标准状况,无法直接用22.4L·mol-1;
⑤参加反应的硝酸有两种作用:其酸性和氧化性,其酸性硝酸的物质的量等于硝酸钠的物质的量,起氧化剂的硝酸的物质的量等于NO的物质的量。
① 沉淀为Al(OH)3和Mg(OH)2,根据原子守恒,其质量应为合金质量和OH-的质量,即m(OH-)=(n-m)g,故①正确;
②当沉淀质量达到最大时,溶液中溶质为NaNO3,即n(NO3-)=n(NaNO3)=n(NaOH)=V×10-3×amol,故②错误;
③在沉淀中OH-的物质的量等于Mg2+、Al3+所带电荷的物质的量,也等于合金失去电子物质的量,即n(e-)=n(OH-)=(n-m)/17mol,故③正确;
④根据得失电子数目守恒,即生成n(NO)=(n-m)/(17×3)mol=(n-m)/51mol,因为室温状态下,因此无法计算NO的体积,,故④不正确;
⑤参加反应的硝酸有两种作用:其酸性和氧化性,因此与合金反应的硝酸的物质的量为[aV×10-3+(n-m)/51]mol,故⑤正确;
综上所述,选项B正确。


科目:高中化学 来源: 题型:
【题目】某有机物的结构为 ,这种有机物不可能具有的性质是( )
,这种有机物不可能具有的性质是( )
A. 能使酸性KMnO4溶液褪色B. 1 mol该有机物最多能与3 mol H2反应
C. 能使溴水溶液褪色D. 能催化氧化生成醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用某种粗盐(含可溶的Ca2+、Mg2+)进行提纯实验,步骤见下图:

请回答:
(1)步骤①和②的操作名称是______________.
(2)步骤③判断加入盐酸“适量”的方法是__________________________;步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止________________,当蒸发皿中有较多量固体出现时,应________________,用余热使水分蒸干.
(3)若固体A中含CaCO3、MgCO3,取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口,小烧杯中观察的现象是________________________,写出发生反应的离子方程式_______________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1200时,天然气脱硫工艺中会发生下列反应:
H2S(g)+3/2O2(g)=SO2(g)+H2O(g) △H1
2H2S(g)+SO2(g)=3/2S2(g)+2H2O(g) △H2
H2S(g)+1/2O2(g)=S(g)+H2O(g) △H3
2S(g)=S2(g) △H4
则△H4的正确表达式为
A. △H4= 2/3(△H1+△H2- 3△H3) B. △H4= 2/3(3△H3-△H1-△H2)
C. △H4= 3/2(△H1+△H2- 3△H3) D. △H4= 3/2(△H1-△H2- 3△H3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(本题共8分)现有部分元素的性质与原子(或分子)结构如下表:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的简单离子中半径最小 |
(1)写出元素T的原子结构示意图 。
(2)元素Y与元素Z相比,金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________(填序号)。
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式:_____ _________。
(4)元素T和氢元素可形成一种18电子的化合物Q,元素X与氢元素也能按原子个数比为1∶2形成一种18电子化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物X的结构简式如图所示,下列有关说法不正确的是
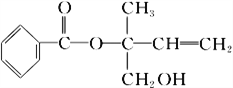
A. X分子中含有三种官能团
B. 可用酸性高锰酸钾溶液区别苯和X
C. X在一定条件下能发生加成、加聚、取代、氧化等反应
D. 在催化剂的作用下,1 mol X最多能与5 mol H2加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某羧酸酯的分子式为C16H22O5,1mol该酯完全水解可得到1mol羧酸和2mol乙醇,该羧酸的分子式为
A.C12H6O5B.C12H18O5C.C12H12O4D.C12H14O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与胶体性质无关的是( )
A.河流入海口处形成沙洲
B.冶金厂常用高压电除去烟尘
C.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
D.在饱和氯化铁溶液中滴加NaOH溶液,产生红褐色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com