
����Ŀ���Ժ���![]() ��ij��Ʒ����
��ij��Ʒ����![]() ��ѧ�����ⶨ������������;�����������Ե�����ָʾ������
��ѧ�����ⶨ������������;�����������Ե�����ָʾ������![]() ����Һ�ζ������
����Һ�ζ������![]() ��Ũ�ȡ����з�����ȷ����
��Ũ�ȡ����з�����ȷ����
��֪��![]() ����
����![]()
����һ![]() ��Ʒ
��Ʒ![]()
![]()
![]() -
-![]()
![]()
![]()
![]()
![]()
������![]() ��Ʒ
��Ʒ![]()
![]() I2
I2![]()
![]()
A.����������Ʒ��������������㣬�������IJⶨ��ȷ
B.������Һ����ɫ��Ϊ��ɫʱ���ﵽ�ζ��յ�
C.����һ�뷽��������������ƷŨ�ȱ�Ϊ6��l
D.���������������õ�������һ������![]() ����Һ������Ƿ�������6��
����Һ������Ƿ�������6��
���𰸡�D
��������
A.����һ�У����ݷ�Ӧ��I-+3Br2��������+3H2O�T6H++6Br-+IO3-��IO3-+5I-+6H+=3I2+3H2O���ɵù�ϵʽ��I-��IO3-��3I2���ɼ�����1�е����ӱ��Ŵ���6���������Ľ����ȷ����A����
B.����һ�ͷ������У��ζ�����ǰ��ҺΪ��ɫ���ζ�����ʱ��Һ����ɫ�����ɫ�����Եζ��յ㶼����Һ����ɫ��Ϊ��ɫ����B����
C.��Ȼ����������ͬ�����Dzⶨ�Ľ��Ӧ����һ���ģ�����һ�뷽��������������ƷŨ�ȱ�Ϊ1��1����C����
D.����һ��Ӧ�Ĺ�ϵʽΪ��I-��IO3-��3I2��6S2O32-����������Ӧ�Ĺ�ϵʽΪ��I-��0.5I2��2S2O32-���ɼ�����һ������Na2S2O3����Һ������Ƿ�������6������D��ȷ��
��ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��PCl3�������л���ũҩ�ͻǰ������ҽҩ��ԭ�ϣ����Ʊ������ǽ����ڻ���(P4)��������������Ȼ���Ӧ��
(1) PCl3��ˮ��ǿ��ˮ�⣬д��PCl3��ˮ��Ӧ�Ļ�ѧ����ʽ��________��
(2) �Ƶõ�PCl3�ֲ�Ʒ�г�����POCl3��PCl5�����ʡ�ͨ��ʵ��ⶨ�ֲ�Ʒ��PCl3������������ʵ�鲽������(���������ʵķ�Ӧ)��
a. Ѹ����ȡ20.00 g PCl3�ֲ�Ʒ����ˮ��ȫˮ��������500.00 mL��Һ��
b. ��ȡ������Һ25.00 mL�ڵ���ƿ�У�����0.500 0 mol��L��1����Һ20.00 mL��1.000 mol��L��1(NH4)3BO3��Һ30.00 mL����
c. ����2��3�ε�����Һ����1.000 0 mol��L��1 Na2S2O3����Һ�ζ������ĵ⣬�����յ�ʱ����Na2S2O3����Һ12.00 mL��
��֪�ⶨ�����еIJ��ַ�ӦΪH3PO3��H2O��I2![]() H3PO4��2HI��3HI��(NH4)3BO3===3NH4I��H3BO3��I2��Na2S2O3�D��Na2S4O6��NaI(δ��ƽ)��
H3PO4��2HI��3HI��(NH4)3BO3===3NH4I��H3BO3��I2��Na2S2O3�D��Na2S4O6��NaI(δ��ƽ)��
�ٲ���b�м���(NH4)3BO3��Һ��Ŀ����________��
���жϲ���c�еζ��յ�ķ���Ϊ________��
�۸����������ݣ������Ƶôֲ�Ʒ��PCl3����������(д���������)��_________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(Al2O3) �͵����裨Si3N4���������ĸ��½ṹ�մɣ��ڹ�ҵ�����ͿƼ���������Ҫ��;��
��1��Al��NaOH��Һ��Ӧ�����ӷ���ʽΪ_____________________________________��
��2������ʵ���ܱȽ�þ�����Ľ�����ǿ������____________������ţ���
a���ⶨþ�����ĵ�����ǿ��
b���ⶨ�����ʵ���Ũ�ȵ�Al2(SO4)3��MgSO4��Һ��pH
c����0.1 mol/L AlCl3��0.1 mol/L MgCl2�мӹ���NaOH��Һ
��3�����ȷ��dz��õĽ���ұ������֮һ��
��֪��4Al (s)+3O2(g) =2Al2O3(s) ��H1 = -3352 kJ/mol
Mn(s)+ O2(g) =MnO2 (s) ��H2 = -521 kJ/mol
Al��MnO2��Ӧұ������Mn���Ȼ�ѧ����ʽ��_____________________________��
��4����ҵ���û�ѧ����������Ʊ������裬�䷴Ӧ���£�
3SiCl4(g) + 2N2(g) + 6H2(g) ![]() Si3N4(s) + 12HCl(g) ��H��0
Si3N4(s) + 12HCl(g) ��H��0
ij�¶Ⱥ�ѹǿ�����£��ֱ�0.3mol SiCl4(g)��0.2mol N2(g)��0.6mol H2(g)����2L�ܱ������ڣ�����������Ӧ��5min�ﵽƽ��״̬������Si3N4(s)��������5.60g��
��H2��ƽ����Ӧ������_________ mol��(L��min)��
������n(SiCl4) : n(N2) : n(H2) = 3 : 2 : 6��Ͷ����ȣ���������������������ϣ�SiCl4(g)��ת����Ӧ______�����������С�����䡱����
��5��298Kʱ��Ksp[Ce(OH)4]��1��10��29��Ce(OH)4���ܶȻ�����ʽΪKsp��_______________��
Ϊ��ʹ��Һ��Ce4��������ȫ������������Һ�е�c(Ce4+)С��1��10��5mol��L��1�������pHΪ______���ϡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ԭ��Ӧ��2Ag����Cu===Cu2����2Ag����Ƶ�ԭ�������ͼ��ʾ��
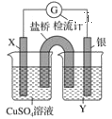
��ش��������⣺
(1)�缫X�IJ�����________��Y��________��
(2)���缫Ϊ��ص�________����X�缫�Ϸ����ĵ缫��ӦΪ_____________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�����Ļ���������ܱ������з������·�Ӧ��![]() ,�ﵽƽ�����A�����Ũ��Ϊ
,�ﵽƽ�����A�����Ũ��Ϊ![]() ,�����¶Ȳ���,���ܱ��������ݻ�ѹ��Ϊԭ����һ���ٴδﵽƽ���,���AŨ��Ϊ
,�����¶Ȳ���,���ܱ��������ݻ�ѹ��Ϊԭ����һ���ٴδﵽƽ���,���AŨ��Ϊ![]() ,������������ȷ����
,������������ȷ����![]()
![]()
A.ƽ��������Ӧ�����ƶ�B.![]()
C.B�����ʵ���Ũ�ȼ�СD.C�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о����������������ڴ����к������ӵ������ʱ���漰���·�Ӧ��
2NO2(g)��NaCl(s)![]() NaNO3(s)��ClNO(g)��K1����H1<0(��)
NaNO3(s)��ClNO(g)��K1����H1<0(��)
2NO(g)��Cl2(g)![]() 2ClNO(g)��K2����H2<0(��)
2ClNO(g)��K2����H2<0(��)
��1��4NO2(g)��2NaCl(s)![]() 2NaNO3(s)��2NO(g)��Cl2(g)��ƽ�ⳣ��K��_______(��K1��K2��ʾ)��
2NaNO3(s)��2NO(g)��Cl2(g)��ƽ�ⳣ��K��_______(��K1��K2��ʾ)��
��2��Ϊ�о���ͬ�����Է�Ӧ(��)��Ӱ�죬�ں��������£���2 L�����ܱ������м���0.2 mol NO��0.1 mol Cl2��10 minʱ��Ӧ(��)�ﵽƽ�⡣���10 min��v(ClNO)��7.5��10��3 mol��L��1��min��1����ƽ���n(Cl2)��________mol��NO��ת������1��________�������������ֲ��䣬��Ӧ(��)�ں�ѹ�����½��У�ƽ��ʱNO��ת������2________��1(����>����<����������)��ƽ�ⳣ��K2______(��������������С������������)����ҪʹK2��С���ɲ�ȡ�Ĵ�ʩ��________��
��3��ʵ���ҿ���NaOH��Һ����NO2����ӦΪ2NO2��2NaOH===NaNO3��NaNO2��H2O����0.2 mol NaOH��ˮ��Һ��0.2 mol NO2ǡ����ȫ��Ӧ��1 L��ҺA����ҺBΪ0.1 mol��L��1��CH3COONa��Һ��������Һ��c(NO![]() )��c(NO
)��c(NO![]() )��c(CH3COO��)�ɴ�С��˳��Ϊ______________________________��(��֪HNO2���볣��Ka��7.1��10��4 mol��L��1��CH3COOH�ĵ��볣��Ka��1.7��10��5 mol��L��1)��ʹ��ҺA����ҺB��pH��ȵķ�����________��
)��c(CH3COO��)�ɴ�С��˳��Ϊ______________________________��(��֪HNO2���볣��Ka��7.1��10��4 mol��L��1��CH3COOH�ĵ��볣��Ka��1.7��10��5 mol��L��1)��ʹ��ҺA����ҺB��pH��ȵķ�����________��
a������ҺA�м�����ˮ b������ҺA�м�����NaOH
c������ҺB�м�����ˮ d������ҺB�м�����NaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����δ֪Ũ�ȵ�����ζ�![]() NaOH��Һ�����в���ʹ�ⶨ���
NaOH��Һ�����в���ʹ�ⶨ���![]() �����Ũ��
�����Ũ��![]() ƫ�͵���( )
ƫ�͵���( )
A.��ʽ�ζ��ܵ����յ���Ӷ���
B.�ζ��ܵζ�ʱ����һ��ճ����ƿ����û��ˮ��ϴ
C.��ʽ�ζ���������ˮϴ��δ�ô���Һ��ϴ
D.��ʽ�ζ��ܵζ�����ּ��촦������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����˹��ȫ�綯����ʹ�õ��������(LiCoO2)��أ��乤��ԭ����ͼ��A�������ǽ���﮺�ʯī�ĸ��ϲ���(ʯī��Ϊ����﮵�����)���������ͨ������Li��ʵ�ֵ��磬��Ĥֻ�����ض�������ͨ������ط�ӦʽLixC6��Li1��xCoO2![]() C6��LiCoO2������˵������ȷ���ǣ� ��
C6��LiCoO2������˵������ȷ���ǣ� ��

A.�ŵ�ʱ�������ص�����A����B���������Һ�Ǻ�Li����ˮ��Һ
B.���ʱAΪ������������ԭ��ӦΪC6��xLi����xe����LixC6
C.�ŵ�ʱBΪ�������缫��ӦʽΪLi1��xCoO2��xLi����xe����LiCoO2
D.�Ͼ������(LiCoO2)��ؽ�������紦����ʹ﮽���ʯī�ж������ڻ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵�����ʾ������ȷ���ǣ� ��
A.HI(g) ![]()
![]() H2(g)+
H2(g)+ ![]() I2(s) ��H = - 26.5kJ/mol����֪ͨ�� 1mol HI ���ܱ������зֽ��ɷų� 26.5kJ ������
I2(s) ��H = - 26.5kJ/mol����֪ͨ�� 1mol HI ���ܱ������зֽ��ɷų� 26.5kJ ������
B.�� C��ʯī����C�����ʯ����H=+1.9kJ/mol ��֪�����ʯ��ʯī�ȶ�
C.�� 101kPa ʱ��2gH2 ��ȫȼ������Һ̬ˮ���ų� 285.8kJ �������� H2 ȼ���ȵĻ�ѧ����ʽ��ʾΪ��2H2��g��+ O2��g��=2H2O��l����H=��285.8kJ/mol
D.��ϡ��Һ�У�H+��aq��+OH����aq���TH2O��l����H=��57.3kJ/mol �������� 0.5mol H2SO4 ��Ũ�����뺬 1mol NaOH����Һ��ϣ��ų����������� 57.3kJ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com