


科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
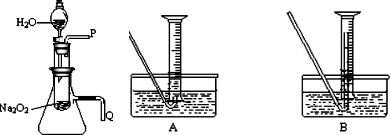 化学课上老师做了一个演示实验:用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.
化学课上老师做了一个演示实验:用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)12.4gNa2X中含Na+0.4mol,则Na2X的摩尔质量是______,
(1)12.4gNa2X中含Na+0.4mol,则Na2X的摩尔质量是______,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 中的化合价是______.
中的化合价是______.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
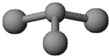 甲、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系.
甲、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com