
【题目】下列说法正确的是( )
A. 溶液呈电中性,胶体带电荷。
B. 配制0.1 mol·L-1CuSO4溶液100 mL,称取1.6g硫酸铜晶体
C. 向饱和Ca(OH)2溶液中加入少量无水CaO固体,恢复原温度,溶液中Ca(OH)2的物质的量浓度不变
D. 制备Fe(OH)3胶体,可向沸水中滴加FeCl3饱和溶液并长时间煮沸
科目:高中化学 来源: 题型:
【题目】有机物G是一种高分子化合物,常用作有机合成的中间体,并可用作乳胶漆等。可以通过以下途径合成:

已知有机物A中含有C、H、O、Cl四种元素且同一个碳原子上不直接连接两个官能团。
(1)A的结构简式为___________或___________;反应③的反应类型_____________________。
(2) 写出反应⑤和反应⑥的化学方程式:反应⑤___________;反应⑥(在一定条件下)___________。
(3)写出1种E的同系物的名称_____________________。写出1种与F含有相同官能团的F的同分异构体的结构简式_______________。
(4)试设计一条以![]() 为原料合成
为原料合成![]() 的合成路线__________________。(合成路线常用的表示方式为:甲
的合成路线__________________。(合成路线常用的表示方式为:甲![]() 乙……
乙……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3(aq)与盐酸反应过程中的能量变化示意图如下,下列选项正确的是
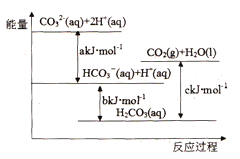
A. H2CO3(aq)=CO2(g)+H2O(l)为放热反应
B. CO32-(aq)+ H+(aq)=HCO3-(aq) △H=akJ/mol
C. HCO3-(aq)+H+(aq)= CO2(g)+H2O(l) △H=(c-b)kJ/mol
D. CO32-(aq)+ 2H+(aq)= CO2(g)+H2O(l) △H=(a+b-c)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸(HOOC—COOH)俗名草酸,是一种有还原性的有机弱酸,在化学上有广泛应用。
(1)小刚在做“研究温度对化学反应速率的影响”实验时,他往A、B两支试管中均加入4 mL 0.01 mol·L-1的酸性KMnO4溶液和2 mL 0.1 mol·L-1 H2C2O4(乙二酸)溶液,振荡,A试管置于热水中,B试管置于冷水中,记录溶液褪色所需的时间。褪色所需时间tA________tB(填“>”“=”或“<”)。已知该反应的离子方程式:2MnO![]() +5H2C2O4+6H+===10CO2↑+2Mn2++8H2O
+5H2C2O4+6H+===10CO2↑+2Mn2++8H2O
(2)实验室有一瓶混有泥沙的乙二酸样品,小刚利用上述反应的原理来测定其含量,具体操作为:
①配制250 mL溶液:准确称量5.000 g乙二酸样品,配成250 mL溶液。
②滴定:准确量取25.00 mL所配溶液于锥形瓶中,加少量酸酸化,将0.100 0 mol·L-1 KMnO4标准溶液装入______(填“酸式”或“碱式”)滴定管,进行滴定操作。
在滴定过程中发现,刚滴下少量KMnO4标准溶液时,溶液紫红色并没有马上褪去。将锥形瓶摇动一段时间后,紫红色才慢慢消失;再继续滴加时,紫红色就很快褪去,可能的原因是__________________________________________;判断滴定达到终点的现象是________________________________________________________________________。
③计算:重复上述操作2次,记录实验数据如下表。则消耗KMnO4标准溶液的平均体积为________ mL,此样品的纯度为____________。
序号 | 滴定前读数 | 滴定后读数 |
1 | 0.00 | 20.01 |
2 | 1.00 | 20.99 |
3 | 0.00 | 21.10 |
④误差下列操作会导致测定结果偏高的是________。
A.未用KMnO4标准溶液润洗滴定管
B.滴定前锥形瓶内有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.观察读数时,滴定前仰视,滴定后俯视
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3可用于生产硝酸和尿素。
(1)生产硝酸:
① NH3催化氧化是工业制硝酸的第一步反应,其化学方程式是_____。
② 除此之外,还可能发生以下副反应:
4NH3 (g)+ 4O2 (g) === 2N2O (g) +6H2O (g) ΔH=-1105 kJ/mol
4NH3 (g) + 3O2 (g) === 2N2 (g) +6H2 O(g) ΔH=-1269 kJ/mol
两个副反应在理论上趋势均很大,但实际生产中影响并不大,原因是_____。
(2)生产尿素:
① 尿素的合成分两步进行:
a.2NH3 (g)+CO2(g) ![]() NH2COONH4(l) ΔH=-117 kJ/mol
NH2COONH4(l) ΔH=-117 kJ/mol
b.NH2COONH4(l) ![]() CO(NH2)2(l)+H2O(l) ΔH=+15 kJ/mol
CO(NH2)2(l)+H2O(l) ΔH=+15 kJ/mol

写出总反应的热化学方程式:______。
② 右图为n(NH3):n(CO2) = 4 : 1时,温度对CO2的转化率的影响。解释温度升高CO2的平衡转化率增大的原因:______。
③ 测定尿素样品含氮量的方法如下:取a g尿素样品,将所含氮完全转化为NH3,所得NH3用过量的v1 mL c1 mol·L1 H2SO4溶液吸收完全,剩余H2SO4用v2 mL c2 mol·L1 NaOH溶液恰好中和,则尿素样品中氮元素的质量分数是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组设计用50 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1氢氧化钠溶液在如图装置中进行中和反应。试回答下列问题:
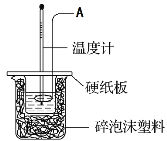
(1)仪器A的名称__________________________
(2)实验过程中下列操作正确是______________(填字母)。
A.用温度计小心搅拌
B.分多次加入氢氧化钠溶液
C.只进行一次实验,用所获得的数据计算中和热
D.用套在温度计上的A轻轻地上下搅动
(3)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=__________ (结果保留一位小数)。
(4)以下操作,会使测得的中和热ΔH发生怎样的变化?(填“偏大”“偏小”或“不变”)。
①量取稀盐酸时俯视量筒读数,测得的中和热ΔH会_______________ 。
②在中和热测定实验中未用水洗涤温度计上的盐酸直接测定碱的温度,测得的中和热ΔH会_______________。
③若用等浓度的醋酸与 NaOH 溶液反应,则测得的中和热ΔH会 __________,其原因是____________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I “碘钟”实验中,3I-+S2O82-===I3—+2SO42-的反应速率可以用![]() 遇加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
遇加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
实验编号 | ① | ② | ③ | ④ | ⑤ |
c(I-)/mol/L | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
c(S2O82-)/mol/L | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
t/s | 88.0 | 44.0 | 22.0 | 44.0 | t1 |
回答下列问题:
(1)该实验的目的是____________________________________________________________。
(2)显色时间t1为________。
(3)通过分析比较上述数据,得到的结论是___________________________________________________。
II根据反应4FeS2+11O2===2Fe2O3+8SO2,试回答下列问题。
(1)通常选用哪些物质来表示该反应的化学反应速率____________。
(2)当生成SO2的速率为0.64 mol·L-1·s-1时,则氧气减少的速率为________。
(3)如测得4 s后O2的浓度为2.8 mol·L-1,此时间内SO2的速率为0.4 mol·L-1·s-1,则开始时氧气的浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示。下列说法错误的是

A. Ksp(MnCO3)的数量级为10-11
B. MgCO3的悬浊液中加入少量水充分振荡,c(Mg2+)不变
C. a点表示的溶液中,c(Ca2+)>c(CO32-)
D. 向浓度均为0.01mol·L-1的Mg2+、Ca2+、Mn2+混合溶液中逐滴加入Na2CO3溶液,最先形成MgCO3沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z为原子序数依次增大的四种短周期元素,其中两种为非金属元素。W的气态氢化物遇到其最高价氧化物对应的水化物产生“白烟”,Z的最外层电子数等于其电子层数的2倍,W和X的最外层电子数之和等于Z的族序数。在含X和Y的可溶性盐溶液中通入过量的CO2,产生沉淀的质量与CO2体积的关系如图所示。下列说法正确的是
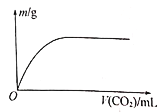
A. 简单离子半径:X>Y>Z>W
B. Z的氧化物对应的水化物均为强酸
C. 含Y的阴离子溶液与含Y的阳离子溶液能够发生反应
D. 工业上可用电解法或热还原法制备X和Y的单质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com