
【题目】一个体重50kg的健康人体内含铁元素2g,这2g铁元素以Fe2+和Fe3+的形式存在。Fe2+易被吸收,所以给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4)。服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收。请回答下列问题:
(1)以下为常见的铁元素的几种微粒,其中既有氧化性又有还原性的是________________。
A .Fe B.Fe2+ C.Fe3+
(2)维生素C可使食物中的Fe3+转化为Fe2+,在此过程中__________是氧化剂,说明维生素C具有____性。
(3)己知下列反应: ①2I-+2Fe3+=2Fe2+ +I2 ②2Fe2++H2O2+2H+=2Fe3++2H2O, 则Fe3+ 、I2 、H2O2三者的氧化性由强到弱为____________________________。
(4)在Fe+4HNO3=Fe(NO3)3+NO↑+2H2O的反应中, HNO3表现的性质为_______ ,毎有1 molFe参加反应转移电子_____________mol。
(5)用双线桥标出该反应Fe+4HNO3=Fe(NO3)3+NO↑+2H2O电子转移的数目和方向______________
【答案】 B Fe3+ 还原性 H2O2>Fe3+>I2 氧化性 酸性 3 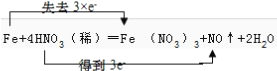
【解析】(1)A .Fe单质中铁的化合价为0,为最低价,只具有还原性,选项A不选;B.Fe2+ 化合价为+2价,处于中间价态,既有氧化性又有还原性,选项B选;C. Fe3+ 为铁的高价态,通常只具有氧化性,选项C不选;答案选B;(2)维生素C可使食物中的Fe3+转化为Fe2+,铁元素的化合价升高,在此过程中Fe3+是氧化剂,将维生素C氧化,说明维生素C具有还原性;(3)反应①2I-+2Fe3+=2Fe2+ +I2 中铁元素化合价由+3价降为+2价,Fe3+为氧化剂,I2为氧化产物,氧化性:Fe3+>I2;②2Fe2++H2O2+2H+=2Fe3++2H2O中氧元素化合价由-1价降为-2价,H2O2为氧化剂,Fe3+为氧化产物,氧化性:H2O2> Fe3+; 则Fe3+ 、I2 、H2O2三者的氧化性由强到弱为:H2O2>Fe3+>I2;(4)在Fe+4HNO3=Fe(NO3)3+NO↑+2H2O的反应中氮元素化合价由+5价降为+2价,被还原,HNO3表现的性质为氧化性,铁元素化合价由0价升高为+3价,被氧化,毎有1 molFe参加反应转移电子3mol;(5)Fe元素的化合价由0升高为+3价,硝酸中N元素的化合价由+5价降低为+2价,该反应中1molFe反应转移3mol电子,则电子转移方向和数目为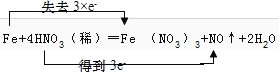 。
。


科目:高中化学 来源: 题型:
【题目】只用一种试剂就可以鉴别乙酸溶液、葡萄糖溶液、蔗糖溶液,这种试剂是( )
A. NaOH溶液B. Cu(OH)2悬浊液
C. 石蕊试液D. Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甘氨酸亚铁络合物[化学式为(NH2CH2COO)2Fe]是常用的补铁剂,其合成方法如下: 
(1)通入N2的作用是 .
(2)已知甘氨酸显弱酸性,其结构简式为NH2CH2COOH,甘氨酸亚铁络合物易溶于水且在水中难电离,写出“水浴加热”过程中生成甘氨酸亚铁络合物的反应的离子方程式
(3)抽滤的好处是 , 从“母液”中回收有机溶剂的方法是 .
(4)“粗品纯化”的操作为蒸馏水洗涤、洗涤、干燥,其中干燥过程使用的设备最好选用(填“常压干燥机”或“真空干燥机”).
(5)有文献指出,若在“水浴加热”过程中投入适量的石灰石,则能同时提高产品的产率和纯度,请解释原因: .
(6)若甘氨酸的投料量为300kg,产出纯品346.8kg,则产率为 . (甘氨酸的相对分子质量为75)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是(△H的绝对值均正确)( )
A.C(s)+ ![]() O2(g)═CO(g)△H=﹣110.5KJmol﹣1(燃烧热)
O2(g)═CO(g)△H=﹣110.5KJmol﹣1(燃烧热)
B.C2H5OH+3O2═2CO2+3H2O△H=﹣1368.8KJmol﹣1(反应热)
C.2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O (l)△H=﹣114.6KJmol﹣1(中和热)
D.2H2O(g)═2H2(g)+O2(g)△H=+483.6KJmol﹣1(反应热)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Cl2+6NaOH ![]() 5NaCl+NaClO3+3H2O,以下叙述正确的是( )
5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A.Cl2是氧化剂,NaOH是还原剂
B.被氧化的氯原子和被还原的氯原子的物质的量之比为5:1
C.Cl2既做氧化剂又做还原剂
D.氧化剂得电子数与还原剂失电子数之比为5:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 0.2 mol·L -1某金属阳离子 Rn+的盐溶液 40mL,恰好将 20 mL 0.4 mol·L -1的硫酸盐中的硫酸根离子完全沉淀,则 n 值为( )
A. 1 B. 2 C. 3 D. 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对药物的认识和使用正确的是
A. 感冒时服用适量阿司匹林B. 大部分药物没有副作用
C. 创可贴能用于伤口消炎D. 胃酸过多只要冲服板蓝根冲剂即可治愈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在KCl、MgCl2、Mg(NO3)2形成的混合溶液中,c(K+)=0.1mol/L,c(Mg2+)=0.15mol/L,c(Cl﹣)=0.2mol/L,则c(NO3﹣)为( )
A.0.05 mol/L
B.0.20 mol/L
C.0.30 mol/L
D.0.40 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com