
“84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶某品牌“84消毒液”,
并查阅相关资料和消毒液包装说明得到如下信息:
“84消毒液”:含25% NaClO、1 000 mL、密度1.19 g·cm-3,稀释100倍(体积比)后使用。请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为________mol·L-1。
(2)该同学取100 mL该品牌“84消毒液”稀释后用于消毒,稀释后的溶液中c(Na+)≈________mol·L-1(假设稀释后溶液密度为1.0 g·cm-3)。
(3)该同学参阅该品牌“84消毒液”的配方,欲用NaClO固体配制480 mL含25% NaClO的消毒液。下列说法正确的是________。
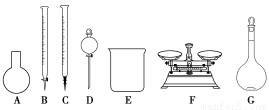
A.如图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143 g
(1)4.0 (2)0.04 (3)C
【解析】(1)根据 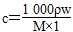 ,
,
c(NaClO)=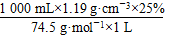
≈4.0 mol·L-1。
(2)4.0 mol·L-1的NaClO溶液稀释100倍后,其浓度为0.04 mol/L,即c(Na+)=0.04 mol/L。
(3)选项A,需用托盘天平称量NaClO固体,需用烧杯来溶解NaClO,需用玻璃棒进行搅拌和引流,需用容量瓶和胶头滴管来定容,图示的A,B、C、D不需要,但还需玻璃棒和胶头滴管;选项B,配制过程中需要加入水,所以经洗涤干净的容量瓶不必烘干后再使用;选项C,由于NaClO易吸收空气中的H2O、CO2而变质,所以商品NaClO可能部分变质导致NaClO减少,配制的溶液中溶质的物质的量减小,结果偏低;选项D,应选取500 mL的容量瓶进行配制,然后取出480 mL即可,所以需要NaClO的质量:0.5 L×4.0 mol·L-1×74.5 g·mol-1=149 g。


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源:2014年高考化学一轮复习课后规范训练3-2练习卷(解析版) 题型:填空题
由短周期元素组成的化合物X是某抗酸药的有效成分。甲同学欲探究X的组成。
查阅资料:①由短周期元素组成的抗酸药的有效成分有碳酸氢钠、碳酸镁、氢氧化铝、硅酸镁铝、磷酸铝、碱式碳酸镁铝。
②Al3+在pH=5.0时沉淀完全;Mg2+在pH=8.8时开始沉淀,在pH=11.4时沉淀完全。
实验过程:
Ⅰ.向化合物X粉末中加入过量盐酸,产生气体A,得到无色溶液。
Ⅱ.用铂丝蘸取少量I中所得的溶液,在火焰上灼烧,无黄色火焰。
Ⅲ.向Ⅰ中所得的溶液中滴加氨水,调节pH至5~6,产生白色沉淀B,过滤。
Ⅳ.向沉淀B中加过量NaOH溶液,沉淀全部溶解。
Ⅴ.向Ⅲ中得到的滤液中滴加NaOH溶液,调节pH至12,得到白色沉淀C。
(1)Ⅰ中气体A可使澄清石灰水变浑浊,A的化学式是________。
(2)由Ⅰ、Ⅱ判断X一定不含有的元素是磷、________。
(3)Ⅲ中生成B的离子方程式是________________________________
(4)Ⅳ中B溶解的离子方程式是_________________________________
(5)沉淀C的化学式是_____________________________________________________。
(6)若上述n(A)∶n(B)∶n(C)=1∶1∶3,则X的化学式是______________________
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练2-2练习卷(解析版) 题型:填空题
某溶液中可能含有OH-、CO32—、AlO2—、SiO32—、SO42—、K+、Na+、Fe3+、Mg2+、Al3+等离子,当向溶液中逐滴加入一定物质的量浓度的盐酸时,生成沉淀的物质的量与加入盐酸体积的关系如图所示[已知:AlO2—+HCO3—+H2O=Al(OH)3↓+CO32—]。回答下列问题:
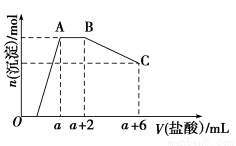
(1)原混合溶液中一定含有的离子是________;
(2)AB段反应的离子方程式是__________________________;
(3)AB段和盐酸反应的离子与BC段和盐酸反应的物质的物质的量之比为______________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练2-1练习卷(解析版) 题型:填空题
对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。
(1)现有下列6种物质:SO2、SiO2、CaO、MgO、Fe2O3、Na2O2。按照不同的分类标准,它们中有一种物质与其他5种有明显的不同,请找出这种物质,并写出依据(写出两种分类方法):
①________________________________。
②________________________________。
(2)从上述物质中分别找出两种能相互反应的物质,各写一个非氧化还原反应的方程式和氧化还原反应的方程式__________________________________________________
(3)虽然分类的方法不同,但离子反应和氧化还原反应之间也存在着一定的关系,请用简单的图示方法表示二者之间的关系:___________________________。
(4)生活中的食醋和淀粉溶液分别属于分散系中的________和________,用________可以鉴别(填化学专用名词)。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练2-1练习卷(解析版) 题型:选择题
潜艇上的核反应堆使用液态铝钠合金(单质钠和单质铝熔合成)
作载热介质,下列有关说法正确的是( )
A.该合金的熔点介于钠、铝之间
B.钠或铝形成的氧化物均为碱性氧化物
C.钠和铝分别与少量的盐酸反应,所得溶液均呈中性
D.若合金中n(Na)>n(Al),将其投入到足量的水中可得无色透明溶液
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练1-3练习卷(解析版) 题型:选择题
将a%的某物质的水溶液加热蒸发掉m g水(溶质不挥发、且蒸发过程无溶质析出),所
得溶液体积为V L,溶质的质量分数为蒸发前的2倍,设溶质的相对分子质量为M,则蒸发后所得溶液的物质的量浓度为( )
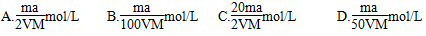
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练1-3练习卷(解析版) 题型:选择题
对1 mol·L-1的BaCl2溶液的有关叙述中,正确的是( )
A.该溶液中Cl-浓度为2 mol·L-1
B.该溶液中Ba2+的物质的量是1 mol
C.可使用250 mL容量瓶分两次完成490 mL该浓度的BaCl2溶液的配制
D.将208 g BaCl2固体溶解在1 L水中,形成的溶液的浓度为1 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练1-1练习卷(解析版) 题型:填空题
铁在冷的浓硫酸中能发生钝化。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。实验室现有下列试剂:0.01 mol/L酸性KMnO4溶液、0.1 mol/L KI溶液、3%H2O2溶液、淀粉溶液、蒸馏水。请你协助他们探究所得溶液和气体的成分。
【提出猜想】
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中可能含有________中的一种或两种。
| 实验操作 | 预期现象 | 结论 |
验证猜想Ⅰ | 步骤①:取少量0.01 mol/L酸性KMnO4溶液,滴入所得溶液 |
|
|
步骤②:________ |
| 含有Fe3 | |
验证猜想Ⅱ | 将所得气体通入如下装置 |
| 含有两种气体 |
【实验探究】
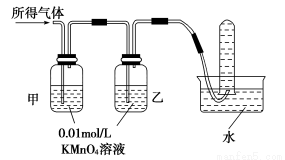
【问题讨论】
有同学提出,若另外选用KSCN溶液,则仅利用KSCN和H2O2两种溶液即可完成猜想Ⅰ的所有探究,判断该方法是否正确并进行评价:_____________________________
查看答案和解析>>
科目:高中化学 来源:2014年高考化学 题型十四 定量计算型专题练习卷(解析版) 题型:选择题
向x mL 2.0 mol·L-1的盐酸中投入a g镁铝合金,金属完全溶解,再加入y mL 1.0 mol·L-1的NaOH溶液沉淀达到最大值,且质量为(a+1.7) g,则下列说法不正确的是 ( )
A.x=2y
B.镁铝合金与盐酸反应时转移电子的数目为0.1NA
C.镁铝合金与盐酸反应产生H2的体积在常温常压下大于1.12 L
D.a的取值范围为0.9 g<a<1.2 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com