
已知:H+(aq) + OH-(aq) ═ H2O(aq) ΔH= -57.3kJ/mol,下列说法正确的是( )
A.NaOH稀溶液分别与稀盐酸和稀醋酸反应生成1 mol H2O ,放出热量相同
B.稀盐酸分别与NaOH稀溶液和稀氨水反应生成1 mol H2O ,放出热量相同
C.Ba(OH)2稀溶液分别与稀盐酸和稀硫酸反应生成1 mol H2O ,放出热量不同
D.该反应说明有水生成的反应是放热反应
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高二10月月考化学试卷(解析版) 题型:选择题
有关甲、乙、丙、丁四个图示的叙述正确的是
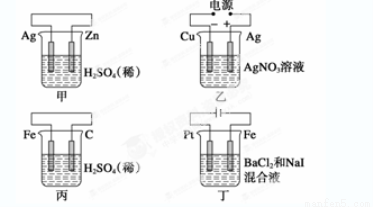
A.甲中负极反应式为2H++2e-===H2↑
B.乙中阳极反应式为Ag++e-===Ag
C.丙中H+向碳棒方向移动
D.丁中电解开始时阳极产生黄绿色气体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江安达市高二第一次月考试卷化学试卷(解析版) 题型:填空题
(11分)高炉炼铁过程中发生的主要反应为:
温度/℃ | 1 000 | 1 150 | 1 300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g) 
 Fe(s)+CO2(g).该反应在不同
Fe(s)+CO2(g).该反应在不同
温度下的平衡常数如下:请回答下列问题:
(1)该反应的平衡常数表达式K= ,
ΔH 0(填“>”、“<”或“=”);
(2)在一个容积为10 L的密闭容器中,1 000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)= ,CO的平衡转化率= ;
(3)欲提高(2)中CO的平衡转化率,可采取的措施是( )
A减少Fe的量 B增加Fe2O3的量 C.移出部分CO2 D.提高反应温度
E.减小容器的容积 F.加入合适的催化剂
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江安达市高二第一次月考试卷化学试卷(解析版) 题型:选择题
下图是温度和压强对X+Y 2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )

A.上述可逆反应的正反应为放热反应
B.X、Y、Z均为气态
C.X和Y中只有一种为气态,Z为气态
D.上述反应的逆反应的△H>0
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江安达市高二第一次月考试卷化学试卷(解析版) 题型:选择题
管道煤气的主要成分是H2、CO和少量的甲烷。相应的热化学反应方程式为:
2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol
2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ/mol
CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ/mol
当使用管道煤气的用户改用天然气后,在相同条件下燃烧等体积的天然气,
理论上所获得的热值,前者大约是后者的多少倍( )
A.0.8 B.1.3 C.3.1 D.0.32
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江哈尔滨第三十二中学高二上学期期中考试化学卷(解析版) 题型:填空题
(8分)已知下列热化学方程式:
①H2(g)+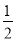 O2(g)===H2O(l) ΔH=-285.8 kJ/mol
O2(g)===H2O(l) ΔH=-285.8 kJ/mol
②H2(g)+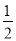 O2(g)===H2O(g) ΔH=-241.8 kJ/mol
O2(g)===H2O(g) ΔH=-241.8 kJ/mol
③C(s)+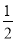 O2(g)===CO(g) ΔH=-110.5 kJ/mol
O2(g)===CO(g) ΔH=-110.5 kJ/mol
④C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
回答下列各问题:
(1)上述反应中属于放热反应的是 。
(2)C的燃烧热为 。
(3)CO的燃烧热为__________;其热化学方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江哈尔滨第三十二中学高二上学期期中考试化学卷(解析版) 题型:选择题
对可逆反应4NH3(g)+ 5O2(g) 4NO(g)+ 6H2O(g),下列叙述正确的是( )
4NO(g)+ 6H2O(g),下列叙述正确的是( )
A.达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
B.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
C.达到化学平衡时,4υ正(O2)= 5υ逆(NO )
D.化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)
查看答案和解析>>
科目:高中化学 来源:2014~2015学年四川省高二入学模拟考试化学试卷(解析版) 题型:选择题
轻轨电车是近年来城市发展的一种无污染的新兴交通工具,当轻轨电车开动时,轻轨电车与架空电线的接触点由于高速摩擦会产生高温,因此接触点上的材料应该具有现耐高温,不易氧化,能导电的性质,你认为接触点上的材料应选用
A.金刚石 B.铝 C.石墨 D.铜
查看答案和解析>>
科目:高中化学 来源:2014-2015湖南省高二上学期期中化学试卷(解析版) 题型:填空题
(10分)在一定温度下,将2 mol A和1 mol B两种气体相混合于体积为2 L的某密闭容器中(容积不变),发生如下反应:3A(g)+B(g) 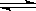 xC(g)+2D(g)ΔH<0,2 min末反应达到平衡状态(温度不变),生成了1mol D,并测得C的浓度为0.5 mol·L-1,请填写下列空白:
xC(g)+2D(g)ΔH<0,2 min末反应达到平衡状态(温度不变),生成了1mol D,并测得C的浓度为0.5 mol·L-1,请填写下列空白:
(1)x的值等于________________。
(2)该反应的化学平衡常数K=________,升高温度时K值将________(选填“增大”、“减小”或“不变”)。
(3)A物质的转化率为__________________。
(4)若维持温度不变,在原平衡混合物的容器中再充入2mol C和2mol D,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充入A的物质的量为________ mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com