
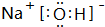 .
.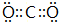 .属非极性分子(填分子极性).EC2其固体属原子晶体.
.属非极性分子(填分子极性).EC2其固体属原子晶体.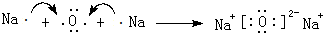 .
.分析 有A、B、C、D、E五种短周期主族元素,原子序数按A、B、C、D、E顺序增大,A是半径最小的原子,则A为H元素;B最外层电子数是次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故B为碳元素;C2-与D+最外层电子数均为次外层的4倍,离子有2个电子层,则C为O元素、D为Na,E和B同主族,则E为Si,据此解答.
解答 解:有A、B、C、D、E五种短周期主族元素,原子序数按A、B、C、D、E顺序增大,A是半径最小的原子,则A为H元素;B最外层电子数是次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故B为碳元素;C2-与D+最外层电子数均为次外层的4倍,离子有2个电子层,则C为O元素、D为Na,E和B同主族,则E为Si.
(1)A、C、D三种元素形成的化合物为NaOH,电子式为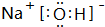 ,
,
故答案为: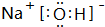 ;
;
(2)CO2的电子式为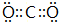 ,为直线型对称结构,属于非极性分子,SiO2固体属原子晶体,
,为直线型对称结构,属于非极性分子,SiO2固体属原子晶体,
故答案为: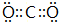 ;非极性;原子;
;非极性;原子;
(3)用电子式表示Na2 O的形成过程: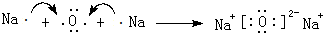 ,
,
故答案为: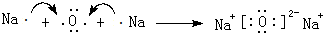 ;
;
(4)碳、Si单质可以形成原子晶体,C-C键长更短,故熔点碳单质>Si单质,Na为金属晶体,沸点熔点较低,而氧气常温下为气体,熔点最低,故单质熔点由高到低的顺序为:C、Si、Na、O2,
故答案为:C、Si、Na、O2.
点评 本题考查结构性质位置关系应用,侧重对化学用语与熔沸点比较的考查,注意掌握熔沸点高低比较规律、用户电子式表示化学键或物质的形成.


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,71g Cl2所含原子数为NA | |
| B. | 标准状况下,22.4L氦气中含有的原子数为2NA | |
| C. | 在非标准状况下,1mol任何气体的体积不可能是22.4L | |
| D. | 常温常压下,32g O2和O3混合气体中含有原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物的总能量低于生成物的总能量时,一定不能自发进行反应 | |
| B. | 已知:CH4(g)+$\frac{3}{2}$O2(g)═2H2O(l)+CO(g)△H,则△H表示CH4的燃烧热 | |
| C. | 恒温恒压时,将2 mol A和1 mol B投入密闭容器中,发生反应:2A(g)+B(g)?2C(g),充分反应后测得放出的热量为Q kJ,则该反应的△H=-Q kJ/mol | |
| D. | 由4P(s,红磷)═P4(s,白磷)△H=+139.2 kJ/mol,可知红磷比白磷稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. |  分散系的分类 | B. |  比较Na2CO3、NaHCO3的稳定性 | ||
| C. |  向Na2CO3溶液中逐滴滴入盐酸 | D. |  向Al溶液中滴加过量的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”.活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量(n/mol)如下表:
车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”.活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量(n/mol)如下表:| 物质 T/℃ | 活性炭 | NO | E | F |
| 初始 | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钱恩 | B. | 屠呦呦 | C. | 弗莱明 | D. | 莫言 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com