
| A、加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铁粉 |
| B、用萃取的方法分离汽油和煤油 |
| C、用溶解和过滤的方法分离硝酸钾和氯化钠固体混合物 |
| D、将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2 |


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:
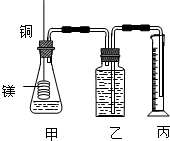 某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积设计的简易实验装置图.该实验的主要操作步骤如下:
某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积设计的简易实验装置图.该实验的主要操作步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2、H2S、Cl2 |
| B、O2、CO2、NO |
| C、O2、H2、SO2 |
| D、NH3、N2、HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 molA+1 molB |
| B、2 molA+1 molB+3 molC+1 molD |
| C、3 molC+1 molD |
| D、3 molC+1 molD+1 molB |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜和锌 | B、镁和铜 |
| C、铝和镁 | D、锌和铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
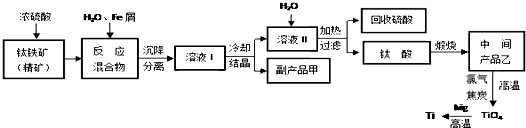
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KClO3是氧化剂 |
| B、HCl是还原剂 |
| C、H2O既不是氧化产物也不是还原产物 |
| D、KCl既是还原产物也是氧化产物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com