
分析 As2O3+6Zn+12HCl=6ZnCl2+2AsH3↑+3H2O中,As元素的化合价由+3价降低为-3价,Zn元素的化合价由0升高为+2价,该反应转移12e-,以此来解答.
解答 解:①As2O3+6Zn+12HCl=6ZnCl2+2AsH3↑+3H2O中,As元素的化合价由+3价降低为-3价被还原,Zn元素的化合价由0升高为+2价,则Zn为还原剂,
根据方程式若参加反应Zn的质量为19.5g,则生成的气体在标准状况下的体积为$\frac{19.5}{65}$×$\frac{1}{3}$×22.4=2.24L,故答案为:Zn;As;2.24;
②As2O3+6Zn+12HCl=6ZnCl2+2AsH3↑+3H2O中,As元素的化合价由+3价降低为-3价,Zn元素的化合价由0升高为+2价,该反应转移12e-,用双线桥法表示电子转移为 ,
,
故答案为: .
.
点评 本题考查氧化还原反应,为高频考点,明确元素的化合价是解答本题的关键,侧重氧化还原反应基本概念及表示方法的考查,难度不大.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:解答题
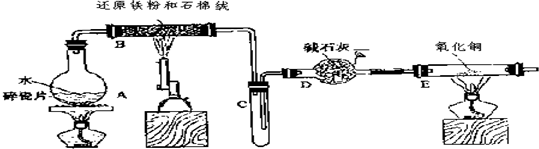
 FeCl3•6H2O晶体
FeCl3•6H2O晶体查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q2<Q1<92.4 | B. | 2Q2=Q1=92.4 | C. | Q1<Q2<92.4 | D. | Q2=Q1<92.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
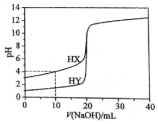 常温下,用浓度为0.1000mol•L-1的NaOH溶液分别逐滴加入到20.00mL 0.1000mol•L-1的HX、HY溶液中,pH随NaOH溶液体积的变化如图.下列说法正确( )
常温下,用浓度为0.1000mol•L-1的NaOH溶液分别逐滴加入到20.00mL 0.1000mol•L-1的HX、HY溶液中,pH随NaOH溶液体积的变化如图.下列说法正确( )| A. | V(NaOH)=10.00 mL时,c(X-)>c(Na+)>c(H+)>c(OH-) | |
| B. | V(NaOH)=20.00 mL时,两份溶液中,c(X-)>c(Y-) | |
| C. | V(NaOH)=20.00 mL时,c(Na+)>c(X-)>c(OH-)>c(H+) | |
| D. | pH=7时,两份溶液中,c(X-)=c(Y-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2>Fe2+>I2 | B. | Cl2>I2>Fe3+ | C. | Cl2>Fe3+>I2 | D. | Fe2+>Cl2>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱用于制造玻璃 | B. | 医药上用小苏打治疗胃酸过多 | ||
| C. | 打磨磁石制指南针 | D. | 工业上利用合成氨实现人工固氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中必有铁 | |
| B. | 浓硫酸和浓盐酸长期露置在空气中浓度均降低 | |
| C. | 将CO2气体分别通入BaCl2溶液、Ba(NO3)2溶液中,最终都有沉淀生成 | |
| D. | 用加热分解的方法可将NH4Cl固体和Ca(OH)2固体的混合物分离 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com