
����Ŀ����Դ���ִ�������ԭ������ͨ����ѧ��������ʹ��������������������ʽת�����Ӷ���������Դ�������Դ�������ʣ���ش��������⡣
��1���ٹ�ҵ�ϳɰ���Ӧ��N2+3H2![]() 2NH3�Ƿ��ȵĿ��淴Ӧ����Ӧ�����Ǹ��¡���ѹ��������Ҫ���ʵĴ�������֪1molN2��ȫ��Ӧ����NH3�ɷų�92kJ�����������10molN2������H2��ϣ�ʹ���ַ�Ӧ���ų�������___����������������С����������������920kJ��
2NH3�Ƿ��ȵĿ��淴Ӧ����Ӧ�����Ǹ��¡���ѹ��������Ҫ���ʵĴ�������֪1molN2��ȫ��Ӧ����NH3�ɷų�92kJ�����������10molN2������H2��ϣ�ʹ���ַ�Ӧ���ų�������___����������������С����������������920kJ��
����֪�Ͽ�1molN![]() N�����յ�����Ϊ945.6kJ���γ�1molN��H���ų�������Ϊ391kJ�����ݻ�ѧ����ʽN2+3H2
N�����յ�����Ϊ945.6kJ���γ�1molN��H���ų�������Ϊ391kJ�����ݻ�ѧ����ʽN2+3H2![]() 2NH3�����ɱ�״����44.8LNH3ʱ�ų�������Ϊ92.4kJ����Ͽ�1molH��H�����յ�������___��
2NH3�����ɱ�״����44.8LNH3ʱ�ų�������Ϊ92.4kJ����Ͽ�1molH��H�����յ�������___��
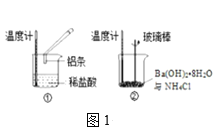
��2��ijʵ��С��ͬѧ������ͼ1��ʾʵ�飬�Լ��黯ѧ��Ӧ�е������仯������������յķ�Ӧԭ���жϣ����е��¶�___����������������������������Ӧ����___���������������������������仯����ͼ2��ʾ��
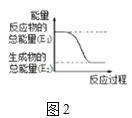
��3����֪��ѧ��ӦA2��g��+B2��g���T2AB��g���������仯��ͼ2��ʾ���÷�Ӧ��___��������������������������Ӧ��
��4����CH3OH��O2����γɵ����ӽ���Ĥȼ�ϵ�صĽṹ��ͼ3��ʾ��

����d�缫��___��������������������������c�缫�ĵ缫��ӦʽΪ___��
������·��ת��2mol���ӣ����ȼ�ϵ�����������ĵ�O2�ڱ�״���µ����Ϊ___L��
���𰸡�С�� 436kJ ���� �� ���� ���� 2CH3OH+2H2O-12e-=2CO2+12H+ 11.2
��������
(2)��Ӧ������������������������������ʾ���Ƿ��ȷ�Ӧ��
(3)��������ĵ缫�������������ڸ�������������Ӧ����CO2�����ϼ۴�-2����+4���Դ�����ƽ�缫��Ӧʽ��
(1)�ٺϳɰ��ǿ��淴Ӧ����Ӧ�ﲻ����ȫת��Ϊ��������Խ�10molN2������H2��ϣ�ʹ���ַ�Ӧ���ų�������С��92kJ���ʴ�Ϊ��С�ڣ�
�ڱ�״����44.8LNH3��2mol NH3����Ͽ�1molH��H�����յ�����Ϊx kJ��![]() ���x=436kJ���ʶϿ�1molH��H�����յ�������436kJ��
���x=436kJ���ʶϿ�1molH��H�����յ�������436kJ��
(2)ͼ1�Т�����������������Ȼ�淋ķ�Ӧ�������ȷ�Ӧ�����¶Ȼή�ͣ�ͼ2�з�Ӧ������������������������������ʾ���Ƿ��ȷ�Ӧ����Ӧ���̢��ǻ��ý�������ķ�Ӧ��Ϊ���ȷ�Ӧ������Ӧ���̢���ͼ2��ʾ���ʴ�Ϊ�����ͣ��٣�
(3)ͼ2�з�Ӧ������������������������������ʾ���Ƿ��ȷ�Ӧ���ʴ𰸣����ȣ�
(4)��d�缫�ǵ������룬˵��d�缫���������缫c�Ǹ����������ڸ�������������Ӧ����CO2����缫��ӦʽΪ2CH3OH+2H2O-12e-=2CO2+12H+���ʴ�Ϊ��������2CH3OH+2H2O-12e-=2CO2+12H+��
�ڸõ��������ӦʽΪ��O2+4H++4e-=2H2O����·��ת��2mol���ӣ����ȼ�ϵ�����������ĵ�O2�����ʵ���Ϊ0.5mol����״���µ����Ϊ0.5mol��22.4L/mol=11.2L���ʴ�Ϊ��11.2��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������X��Y��Z��M��N�����ǵ������ӿ�����SO42-��Cl����NO3-��CO32-�������ӿ�����Ag����NH4+��Na����Al3����Cu2����Ba2����Fe3������֪����M����ɫ��Ӧ�ʻ�ɫ���������ξ�������ˮ��ˮ��Һ��Ϊ��ɫ����X����Һ�����ԣ�Y��Z��N����Һ�����ԣ�M����Һ�ʼ��ԡ��������������ε���Һ�зֱ����Ba(NO3)2��Һ��ֻ��X��Z����Һ�������������������������ε���Һ�У��ֱ���백ˮ��N��Z����Һ�����ɳ����������Ӱ�ˮ��Z�г�����ʧ���ް�X����Һ�ֱ���뵽Y��Z��N����Һ�У��������ɲ�����ϡ����ij�������ش��������⣺
��1���������У�������������ͬ�������εĻ�ѧʽ��______________��
��2��M��Һ�Լ��Ե�ԭ����(�����ӷ���ʽ��ʾ)_______________________��
��3��X��Z����Һ��Ӧ�����ӷ���ʽ��______________________________��
��4��N�Ͱ�ˮ��Ӧ�����ӷ���ʽ��_____________________________________��
��5����Ҫ����Y�������������ӣ���ȷ��ʵ�鷽����_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA���������ӵ���������֪C2H4��C4H8�Ļ���������Ϊag ������˵����ȷ�ģ� ��
A. ȼ��ʱ���ĵ�O2һ����33.6a/14 LB. ����̼�����ĿΪ2aNA/7
C. ������ԭ������Ϊ3aNA/14D. �������õ��Ӷ���ĿΪ3a NA /14
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����[aX+bY]Ϊa��X����b��Y����ɵ�һ���������壬NAΪ�����ӵ�������ֵ������˵������ȷ���ǣ� ��
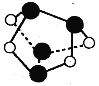
A.0.5mol�ۻ�(As4S4����֪As��Nͬ���壬�ṹ��ͼ)����NA��S-S��
B.�ϳɰ���ҵ�У�Ͷ��1mol[N2(g)+3H2(g)]������2NA��[NH3(g)]
C.�ö��Ե缫���1LŨ�Ⱦ�Ϊ2molL-1��AgNO3��Cu(NO3)2�Ļ����Һ������0.2NA�����ӷ���ת��ʱ����������6.4g����
D.273K��101kPa�£�1mol������������к��еĹ��õ��Ӷ���ĿΪ3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D��E��F����Ԫ�أ������������������ƶϣ�
��A��B��C��ͬһ���ڵĽ���Ԫ�أ���֪ԭ�Ӻ�����3�����Ӳ㣬A��ԭ�Ӱ뾶�����������������ԭ�Ӱ뾶��A��B��C��
��D��E�Ƿǽ���Ԫ�أ��������⻯�Ͽ�������̬�⻯��HD��H2E�������£�D�ĵ����ǻ������壬E�ĵ����ǵ���ɫ���壻
��F�Ƿǽ�������ǿ��Ԫ��
��1��A�ڼ������������ɵ�������ĵ���ʽΪ___�����еĻ�ѧ��������___��D��Ԫ�����ڱ���λ����___��
��2���õ���ʽ��ʾB��DԪ���γɵĻ�������γɹ��̣�___��
��3���Ƚ�D��E���⻯���ȶ���ǿ����___���ѧʽ����D��E��F�����Ӱ뾶�ɴ�СΪ___�������ӷ��ţ���
��4��C�������������ڵ�ˮ����Ļ�ѧʽΪ___����A������������Ӧ��ˮ���ﷴӦ�����ӷ���ʽΪ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������Ԫ����ɡ�ij��ѧ�о�С�鰴��ͼ����̽������ɣ�

��֪���Ͷ�����Է���������ͬ�ij������壬���ж��ǿ�������Ҫ�ɷ�֮һ����ش��������⣺
��1���Ļ�ѧʽΪ____��
��2��������ը��Ӧ�Ļ�ѧ����ʽΪ____��
��3����֪��������У�������Ԫ�صĻ��ϼ�Ϊ������ۣ�������Ԫ�صĻ��ϼ�Ϊ����ۣ���ը��Ӧ�б�������Ԫ���뻹ԭ��������ʵ���֮��Ϊ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
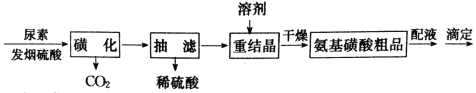
����Ŀ����������(H2NSO3H)��һԪ����ǿ�ᣬ�׳ơ��������ᡱ��������ˮ��Һ�����������Ҵ����ڹ�ҵ�ϳ�����������ϴ������ȼ�����ǻ����ȡ�ijʵ���������غͷ�������(����SO3������)�Ʊ����������������ͼ��
��֪���ǻ������跢���ķ�ӦΪ��
��CO(NH2)2(s)+SO3(g)![]() H2NCONHSO3H(s) ��H��0
H2NCONHSO3H(s) ��H��0
��H2NCONHSO3H+H2SO4![]() 2H2NSO3H+CO2��
2H2NSO3H+CO2��
�������ǻ������跴Ӧ��װ����ͼ1��ʾ����ش��������⣺
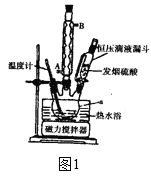
��1�����й��ڡ��ǻ����롰���ˡ������˵������ȷ����____��
A.����a��������������ƿ
B.��������ʱ������ˮӦ�ô������ܵ�B�ܿ�ͨ��
C.���˲���ǰ��Ӧ�Ƚ���С��©���ھ�ȴ���ܽ�ȫ��С��ס����ֽƽ���ڲ���©���У�������ʪ��ֽ����ˮ��ͷ������ʹ��ֽ������©���ɰ��ϣ���ת������Һ
D.���˽�����Ϊ�˷�ֹ������Ӧ�ȹر�ˮ��ͷ���ٲ������ӳ����ú�����ƿ֮�����Ƥ��
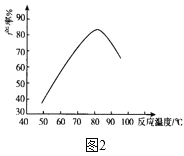
��2�����ǻ��������¶�����ʵĹ�ϵ��ͼ2��ʾ�����Ʒ�Ӧ�¶�Ϊ75��80��Ϊ�ˣ����¶ȸ���80�棬��������IJ��ʻή�ͣ����ܵ�ԭ����____��
��3�������ˡ�ʱ�����þ���Ҫ���Ҵ�ϴ�ӣ���ϴ�ӵľ��������____��
��4�����ؽᾧ��ʱ���ܼ�ѡ��10%��12%���������������ˮ��ԭ����____��
��5������Һ���ζ��������У�ȷ��ȡ2.500g���������Ʒ���250mL����Һ��ȡ25.00mL����Һ����ƿ�У��Ե���-�⻯����Һ��ָʾ������0.08000molL-1��NaNO2����Һ���еζ�������Һǡ�ñ���ʱ������NaNO2����Һ25.00mL����ʱ��������ǡ�ñ���ȫ������N2��NaNO2�Ļ�ԭ����ҲΪN2��
�ٵ�����ƽʹ��ǰ��____������У������ʱ�����Ƚ��ྻ�����С�ձ����ڳ������룬��ʾ�����ȶ���____���ٻ�������Ʒ����������ʱ��ֹͣ������������¼��
�����������Ʒ�Ĵ��ȣ�____(������������ʾ)��
�����Է�̪Ϊָʾ������0.08000molL-1��NaOH����Һ���еζ���Ҳ�ܲⶨ���������Ʒ�Ĵ��ȣ�����ý��ͨ����NaNO2��____(�ƫ�ߡ���ƫ�͡�)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڷ����������л���Ľṹ��ʽ�����ش��й����⣺
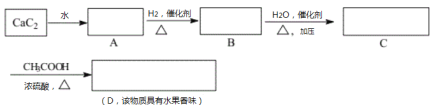
(1)д��A��B��C��D�Ľṹ��ʽ��A��___________ B��____________C��___________ D��____________
(2)A��B�Ļ�ѧ��Ӧ����ʽ��___________________________����Ӧ������___________��
(3) C��D�Ļ�ѧ��Ӧ����ʽ��___________________________����Ӧ������___________��
(4)B��һ�������¿����ɾۺ���仯ѧ����ʽ��___________________����Ӧ������_________���������ϻ���ɰ�ɫ��Ⱦ��ԭ����____________________________��
(5)A��һ��������Ҳ�����ɾۺ���![]() �����Ƿ������־ۺ�����Ե��磬�Ӷ����о��Ӧ��ǰ������һ������˼������ϸ����ǵ���ʾ��_______________________________________________��
�����Ƿ������־ۺ�����Ե��磬�Ӷ����о��Ӧ��ǰ������һ������˼������ϸ����ǵ���ʾ��_______________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��С��Ϊ��֤NO2��ˮ��Ӧ�IJ������ͼ��ʾװ�ý���ʵ�飨�г�װ������ȥ���������Ѽ��飩��
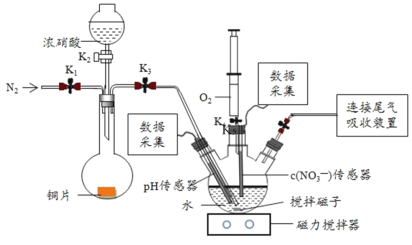
��ʵ����̣�
ʵ�鲽�� | ʵ������ |
������K1��K3��K5���ر�K2��K4��ͨ�� һ��ʱ��N2���ر�K1 | _________ |
������K2����������ŨHNO3��ͬʱ��pH��������NO3�D����������¼���� | Բ����ƿ�з�Ӧ���ң�ͭƬ���ܽ⣬��Һ��Ϊ����ɫ��_________��Ƭ�̺�����ƿ�ڵĵ��ܿ�������ð�� |
III��5min��K4����ע��������������ע������ƿ���ر�K4 | ����ƿ�ڵ��������ɫ��Ϊdz����ɫ |
����II�У���������¼������ͼ��ʾ��
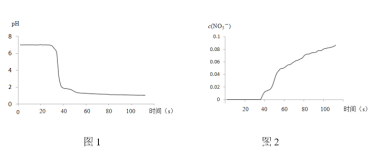
�����ͼ����ۣ�
��1��NO2��ˮ��Ӧ�����ӷ���ʽΪ____________ ��
��2������I�У�ͨ��N2��Ŀ����____________��
��3��������II��Բ����ƿ�ڵ�ʵ������������____________��
��4����ʵ����֤NO2��ˮ��Ӧ�����ʵ��֤�ݰ���____________������ţ���
A.Բ����ƿ����Һ��Ϊ����ɫ
B.����ƿ�ڵ��������ɫ��Ϊdz����ɫ
C.pH��������¼��������
D.![]() ��������¼��������
��������¼��������
��5����ͬѧ��Ϊ��ʵ�鲻�Ͻ�����ΪҲ���ܵ��´���������¼�����ݽ��____________
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com