
| A. | 16 | B. | 17 | C. | 18 | D. | 15 |
分析 根据酸、碱溶液的pH分别计算出溶液中氢离子、氢氧根离子的浓度,然后结合“n(A-):n(HA)=1:99”可计算出弱酸HA的浓度;将1体积的此强碱溶液与100体积的HA溶液混合,恰好完全反应,则n(酸)=n(碱),据此列式计算即可.
解答 解:常温下,某一元酸HA溶液的pH为b,c(H+)=10-bmol/L,根据n(A-):n(HA)=1:99可知溶液中c(HA)=99c(A-),则溶液中溶质HA的浓度为c(HA)=100c(H+)=10-b+2mol/L;
某一元强碱溶液的pH为a,则该一元强碱溶液的浓度为10a-14mol/L,
若将1体积的此强碱溶液与100体积的HA溶液混合,恰好完全反应,则n(酸)=n(碱),即:10-b+2mol/L×100=10a-14mol/L×1,
解得:a+b=18,
故选C.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,根据题干信息正确计算出HA的物质的量浓度为解答关键,注意熟练掌握溶液酸碱性与溶液pH的关系及计算方法,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 负极的电极反应式为Al-3e-→Al3+ | |
| B. | 该电池的总反应式为2Li+FeS═Li2S+Fe | |
| C. | LiAl在电池中作为负极材料,该材料中Li的化合价为+1 | |
| D. | 充电时,阴极发生的电极反应式为Li2S+Fe-2e-═2Li++FeS |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据分散质粒子能否透过滤纸,可以将分散系分为溶液、胶体和浊液 | |
| B. | 根据某物质中是否含有氢元素,判断该物质是否属于酸 | |
| C. | 根据化学反应前后,是否有电子转移,判断反应是否属于氧化还原反应 | |
| D. | 根据某物质中是否含有氧元素,可以判断该物质是否属于氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有② | B. | 只有②③ | C. | 只有①② | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 烯类化合物 | 相对速率 |
| (CH3)2C=CHCH3 | 10.4 |
| CH3CH=CH2 | 2.03 |
| CH2=CH2 | 1.00 |
| CH2=CHBr | 0.04 |
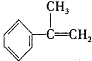 与HBr反应的主要产物的结构简式
与HBr反应的主要产物的结构简式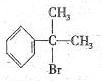 .
.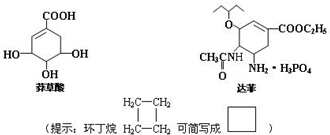
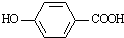 ),其反应类型为:消去反应;
),其反应类型为:消去反应;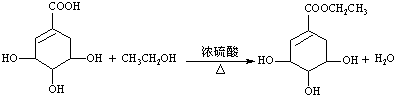 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
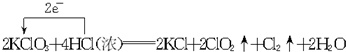 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
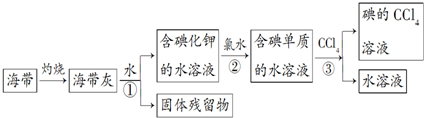
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com