
| A. | 标准状况下,2.24L由O2和O3组成的混合气体中含有的原子数为0.2NA | |
| B. | 1L0.1mol•L-1NaHCO3溶液中所含HCO3-的数目为0.1NA | |
| C. | 一定条件下,0.1molCO与0.1molH2O(g)充分反应,生成H2的分子数为0.1NA | |
| D. | 在反应:3FeS2+12C+8O2═Fe3O4+12CO+6S中,每生成0.6molS,转移的电子数为3.2NA |
分析 A.1个氧气分子含有2个氧原子,1个臭氧分子含有3个氧原子;
B.碳酸氢根离子为弱酸的酸式根离子,水溶液中部分水解;
C.一氧化碳与水蒸汽反应为可逆反应;
D.反应3FeS2+12C+8O2=Fe3O4+12CO+6S中,Fe元素化合价部分由+2价升高到+3价,S元素化合价由-1价升高到0价,C元素化合价由0价升高到+2价,O由0价降为-2价,据此解答.
解答 解:A.标准状况下,2.24L由O2和O3组成的混合气体物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,含有的原子数大于0.2NA,故A错误;
B.碳酸氢根离子为弱酸的酸式根离子,水溶液中部分水解,所以1L0.1mol•L-1NaHCO3溶液中所含HCO3-的数目小于0.1NA,故B错误;
C.一氧化碳与水蒸汽反应为可逆反应,可逆反应不能进行到底,所以一定条件下,0.1molCO与0.1molH2O(g)充分反应,生成H2的分子数小于0.1NA,故C错误;
D.从化学方程式可看出Fe、S、C三种元素的化合价均升高,所以被氧化的物质为FeS2和C,生成0.6硫时,消耗0.8mol氧气,转移电子0.8mol×4=3.2mol,转移的电子数为3.2NA,故D正确;
故选:D.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件为解答关键,试题培养了学生的化学计算能力.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:解答题
 水是生命的源泉、工业的血液、城市的血脉.要保护好河流,因为河水是主要的饮用水源,污染物通过饮用水可直接毒害人体,也可通过食物链和灌溉农田间接危及健康.请回答下列问题:
水是生命的源泉、工业的血液、城市的血脉.要保护好河流,因为河水是主要的饮用水源,污染物通过饮用水可直接毒害人体,也可通过食物链和灌溉农田间接危及健康.请回答下列问题:| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 →
→
 $\stackrel{-H_{2}}{→}$
$\stackrel{-H_{2}}{→}$ 
 →
→
| A. | 通过裂解可以从石油中获得更多的乙烯 | |
| B. | 把煤干馏可以得到粗苯,经分馏可以得到苯 | |
| C. | 制聚苯乙烯的反应①为取代反应,②为消去反应③为加聚反应 | |
| D. | 反应①②③的原子利用率不都为100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知化合物B3N3H6(硼氮苯)与C6H6(苯)的分子结构相似,如图,则硼氮苯的二氯取代物B2N3H4Cl2的同分异构的数目为( )
已知化合物B3N3H6(硼氮苯)与C6H6(苯)的分子结构相似,如图,则硼氮苯的二氯取代物B2N3H4Cl2的同分异构的数目为( )| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将燃油车改为燃气车有利于减少污染物排放 | |
| B. | 含氟牙膏能有效预防龋齿,且其中所加氟化物的量宜多不宜少 | |
| C. | 糖类、油脂及蛋白质都含有C、H、O元素 | |
| D. | 酸雨浸蚀的土壤中加入熟石灰,可对该土壤进行修复 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
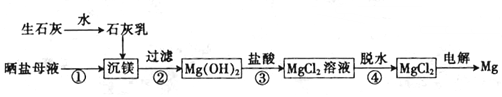
| A. | 上述工艺流程中未涉及置换反应 | |
| B. | 设计步骤①、②、③的主要目的是富集MgCl2 | |
| C. | 脱水时在HCl气氛中进行可防止MgCl2发生水解 | |
| D. | 电解得到的炽热镁粉可在二氧化碳气氛中冷却 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | -- | -- | -- |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有单质参加或有单质生成的化学反应一定是氧化还原反应 | |
| B. | 有单质生成的分解反应属于氧化还原反应 | |
| C. | 没有单质参加的化合反应一定是非氧化还原反应 | |
| D. | 氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;溴化钠中存在的化学键是离子键,
;溴化钠中存在的化学键是离子键, ,溴化钠的电离方程式为NaBr=Na++Br-.检验某固体试样中是否有Br-的方法为取固体试样少许用蒸馏水溶解,再滴加硝酸酸化的硝酸银溶液,若有浅黄色沉淀生成,则证实有Br-存在.
,溴化钠的电离方程式为NaBr=Na++Br-.检验某固体试样中是否有Br-的方法为取固体试样少许用蒸馏水溶解,再滴加硝酸酸化的硝酸银溶液,若有浅黄色沉淀生成,则证实有Br-存在.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com