
【题目】物质世界丰富多彩,可以分类认识和研究。下列依据不同角度对物质分类正确的是
A.金属单质在化学反应中化合价升高,是氧化剂
B.Na2O、CaO与酸反应只生成盐和水,均属于碱性氧化物
C.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
D.盐酸和熔融的烧碱均能导电,都是电解质
 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】三硫化四磷是黄绿色针状结晶,其结构如图所示,不溶于冷水,溶于叠氮酸、二硫化碳、苯等有机溶剂.在沸腾的NaOH稀溶液中会迅速水解.回答下列问题:
(1)Se是S的下一周期同主族元素,其核外电子排布式为;
(2)第一电离能:S(填“>”“<”或“=”,下同)P;电负性:SP.
(3)三硫化四磷分子中P原子采取杂化,与PO3﹣互为等电子体的化合物分子的化学式为 .
(4)二硫化碳属于(填“极性”或“非极性”)分子.
(5)用NA表示阿伏加德罗常数的数值,0.1mol三硫化四磷分子中含有的孤电子对数为 .
(6)纯叠氮酸(HN3)在常温下是一种液体,沸点较高,为308.8K,主要原因是 .
(7)氢氧化钠具有NaCl型结构,其晶饱中Na+与OH﹣之间的距离为acm,晶胞中Na+的配位数为 , 用NA表示阿伏加德罗常数的数值,NaOH的密度为 gcm﹣3 . 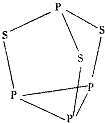
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72﹣(橙色)+H2O2CrO42﹣(黄色)+2H+ . 用K2Cr2O7溶液进行下列实验: 
结合实验,下列说法不正确的是( )
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72﹣被C2H5OH还原
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空 
(1)根据图1请写出合成氨的热化学方程式(热量用E1、E2或E3表示).
(2)实验测得0.01mol/L的KMnO4的硫酸溶液和0.1mol/L的H2C2O4溶液等体积混合后,反应速率υ[mol/(Ls)]与反应时间t(s)的关系如图2所示.该反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O,回答如下问题:
①0→t2时间段内反应速率增大的原因是: ,
②t2→t时间段内反应速率减小的原因是: ,
③图中阴影部分“面积”表示t1→t3时间里 .
A.Mn2+物质的量浓度的增大 B.Mn2+物质的量的增加
C.SO42﹣物质的量浓度 D.MnO4﹣物质的量浓度的减小.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,在蒸发皿中放一小块钠,加热至熔化时,用玻璃棒蘸取少量无水CuSO4与熔化的钠接触,瞬间产生耀眼的火花,同时有红色物质生成。据此判断下列说法中不正确的是

A.上述反应是置换反应
B.上述反应是放热反应
C.加热且无水条件下,Na可以与CuSO4反应并生成Cu
D.上述反应中CuSO4表现了还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氮的说法正确的是( )
A.N2分子的结构较稳定,因而氮气不能支持任何物质燃烧
B.23 g NO2和N2O4混合气含有0.5NA个氮原子(NA表示阿伏加德罗常数)
C.NO可用向上排空气法或者排水法收集
D.浓硝酸保存在棕色瓶内是因为硝酸易挥发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO(g)+Cl2(g)2ClNO(g)△H<0
写出该反应的平衡常数表达式 .
为研究不同条件对反应的影响,:在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2 , 10min时反应达到平衡.测得10min内v(ClNO)=7.5×10﹣3 molL﹣1min﹣1 , 则平衡后n(Cl2)=mol,NO的转化率α1= . 其他条件保持不变,反应在恒压条件下进行,平衡时NO的转化率α2α1(填“>”“<”或“=”),平衡常数K(填“增大”“减小”或“不变”).若要使K减小,可采取的措施是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科学实验小组将6mol A和 8mol B 充入2L的密闭容器中,某温度下,发生的反应为A(g)+3B(g)C(g)+D(g)△H=﹣49.0 kJmol﹣1 . 测得B的物质的量随时间变化的关系如图所示(实线). 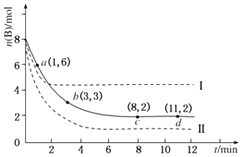
(1)下列时间段A的平均反应速率最大的是(填选项字母,下同),最小的是 .
A.0~1min B.1~3min C.3~8min D.8~11min
(2)b点的正反应速率(填“大于”“等于”或“小于”)逆反应速率.
(3)平衡时B的转化率为 , 该温度下的化学平衡常数K= .
(4)仅改变某一实验条件再进行两次实验,测得B的物质的量随时间变化如图中虚线所示.则曲线Ⅰ改变的条件是 , 曲线Ⅱ改变的条件是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某2L恒容密闭容器中充入2mol X(g)和1mol Y(g)发生反应:2X(g)+Y(g)3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示.下列推断正确的是( ) 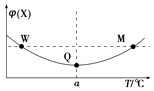
A.升高温度,平衡常数减小
B.W,M两点Y的正反应速率相等
C.平衡后充入Z达到新平衡时Z的体积分数增大
D.M点时,Y的转化率最大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com