
分析 常温时,取0.1mol•L-1HX溶液与0.1mol•L-1 NaOH溶液等体积混合(混合后溶液体积的变化不计),酸碱的物质的量相等,二者恰好反应生成NaX,测得混合溶液的pH=8,混合溶液呈碱性,说明NaX是强碱弱酸盐,则HX是弱酸;
①混合溶液中由水电离出的c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-8}}$mol/L=10-6mol/L,0.1mol/LNaOH溶液中由水电离出的c(OH-)=$\frac{1{0}^{-14}}{0.1}$mol/L=10-13mol/L;
②NH4X溶液是中性,说明NH4+和X-离子水解程度相等,则一水合氨和HX电离平衡常数相等,HX溶液加入到Na2CO3溶液中有气体放出,说明HX酸性大于H2CO3,则CO32-水解程度大于NH4+.
解答 解:常温时,取0.1mol•L-1HX溶液与0.1mol•L-1 NaOH溶液等体积混合(混合后溶液体积的变化不计),酸碱的物质的量相等,二者恰好反应生成NaX,测得混合溶液的pH=8,混合溶液呈碱性,说明NaX是强碱弱酸盐,则HX是弱酸;
①混合溶液中由水电离出的c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-8}}$mol/L=10-6mol/L,0.1mol/LNaOH溶液中由水电离出的c(OH-)=$\frac{1{0}^{-14}}{0.1}$mol/L=10-13mol/L,则合溶液中由水电离出的c(OH-)与0.1mol•L-1NaOH溶液中由水电离出的c(OH-)之比=10-6mol/L:10-13mol/L=107:1,故答案为:107:1;
②NH4X溶液是中性,说明NH4+和X-离子水解程度相等,则一水合氨和HX电离平衡常数相等,HX溶液加入到Na2CO3溶液中有气体放出,说明HX酸性大于H2CO3,则CO32-水解程度大于NH4+,所以该溶液呈碱性,pH>7,
故答案为:>.
点评 本题考查酸碱混合溶液定性判断、盐类水解等知识点,侧重考查学生分析判断能力,难点是计算①两种溶液中水电离出c(OH-)的方法,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体[A12(SO4)3•18H2O].
利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体[A12(SO4)3•18H2O].查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性 | B. | 还原性 | C. | 碱性 | D. | 酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
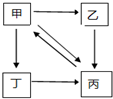 下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )| 甲 | 乙 | 丙 | 丁 | |
| A | Cu | CuCl2 | CuO | Cu(NO3)2 |
| B | Na2CO3 | NaOH | NaHCO3 | CO2 |
| C | Fe | FeCl3 | Fe(OH)3 | Fe2O3 |
| D | Al2O3 | Al(OH)3 | NaAlO2 | AlCl3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 若X是盐桥,则电子由B电极经外电路流向A电极 | |
| B. | 若X是铜条,则A电极的电极反应式是:Zn2++2e-═Zn | |
| C. | 若X是石墨条,则乙池溶液的PH不变 | |
| D. | 若X 是锌条,则A电极的质量会减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8g的NH4+离子中含有的电子数0.1NA | |
| B. | 1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA个电子 | |
| C. | 1 mol Al分别放入足量的冷的浓HNO3、稀HNO3中,反应后转移电子均为3NA | |
| D. | 标准状况下,11.2LH2O中含有的分子数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 向100mL FeI2溶液中逐渐通入Cl2,会依次生成I2、Fe3+、IO3-,其中Fe3+、I2的物质的量随n(Cl2)的变化如图所示,请回答下列问题:
向100mL FeI2溶液中逐渐通入Cl2,会依次生成I2、Fe3+、IO3-,其中Fe3+、I2的物质的量随n(Cl2)的变化如图所示,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用FeCl3溶液腐蚀印刷电路板上铜箔:Fe3++Cu═Fe2++Cu2+ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 用小苏打治疗胃酸过多:CO${\;}_{3}^{2-}$+2H+═CO2↑+H2O | |
| D. | 偏铝酸钠溶液中通入过量CO2:AlO${\;}_{2}^{-}$+CO2+2H2O═Al(OH)3↓+HCO${\;}_{3}^{-}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com