
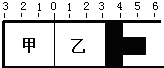
 已知一定温度和压强下,在容积为VL的密闭容器中充入1molA和1molB,保持恒温恒压下反应:A(g)+B(g)?C(g)△H<0.达到平衡时,C的体积分数为40%.试回答有关问题:
已知一定温度和压强下,在容积为VL的密闭容器中充入1molA和1molB,保持恒温恒压下反应:A(g)+B(g)?C(g)△H<0.达到平衡时,C的体积分数为40%.试回答有关问题:| a |
| 2-a+2-a+a |
| 8 |
| 7 |
| 8 |
| 7 |
| 20 |
| 7 |
| ||
| 1mol+1mol |
| 10 |
| 7 |
| 10 |
| 7 |


 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+一定存在 |
| B、每份取样溶液中含0.02mol CO32- |
| C、Cl-可能存在 |
| D、Ba2+一定不存在,Mg2+可能存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.8×10-6 mol?L-1 |
| B、4.2×10-6mol?L-1 |
| C、2.8×10-4 mol?L-1 |
| D、8.4×10-4 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| (三) | (一) | (五) | (二) | (六) | (四) |
 |  |  |  | 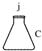 |  |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com