
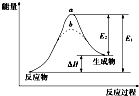
| A. | 逆反应的活化能小于正反应的活化能 | |
| B. | a、b分别对应有催化剂和无催化剂的能量变化 | |
| C. | 该反应的反应热△H=E2-E1 | |
| D. | 催化剂能改变反应的焓变 |
分析 A、根据图象,逆反应的活化能为E2,正反应的活化能为E1来回答;
B、加入催化剂不会改变化学反应的焓变,但是会降低反应的活化能;
C、根据焓变的概念△H=产物的总焓-反应物的总焓来回答;
D、加入催化剂不会改变化学反应的焓变.
解答 解:A、根据图象,逆反应的活化能为E2,正反应的活化能为E1,所以逆反应的活化能小于正反应的活化能,故A正确;
B、催化剂会降低反应的活化能,a、b分别对应无催化剂和有催化剂的能量变化,故B错误;
C、焓变△H=产物的总焓-反应物的总焓=△H=E1-E2,故C错误;
D、加入催化剂不会改变化学反应的焓变,故D错误.
故选A.
点评 本题考查了反应能量变化的分析判断,图象分析是解题关键,反应的能量守恒是判断的依据,注意加入催化剂不会改变化学反应的焓变,会降低反应的活化能.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;镁条在气体B中燃烧生成的物质是Mg3N2(填化学式);
;镁条在气体B中燃烧生成的物质是Mg3N2(填化学式);查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳的燃烧热大于110.5 kJ/mol | |
| B. | ①的反应热为221 kJ/mol | |
| C. | 稀硫酸与稀NaOH溶液反应的中和热为57.3 kJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ 热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小于50mL | B. | 等于50mL | C. | 大于50mL | D. | 等于50/ρmL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol NH4+所含有的电子数为11 NA | |
| B. | 20g氖气所含有的分子数约为 3.01×1023 | |
| C. | 标准状况下,22.4LSO2气体所含的原子数为 NA | |
| D. | 常温常压下,32gO2和O3的混合气体所含原子数为2 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com