
【题目】元素周期表中钌(Ru)与铁相邻位于铁的下一周期,某钌光敏太阳能电池的工作原理如下图所示,图中RuII*表示激发态。下列说法正确的是( )

A. 电池工作时,直接将太阳能转化为电能
B. 镀铂导电玻璃的作用是传递I-
C. 电池的电解质溶液中I- 和I3-的浓度不断减小
D. 电解质溶液中发生反应:2Ru3+ + 3I-= 2Ru2+ + I3-
【答案】D
【解析】
由图中电流移动方向可知,镀Pt导电玻璃为正极,I3-在正极上放电发生还原反应生成I-,电极反应式为I3-+2e-=3I-,透明导电玻璃为负极,钌(RuII)的配合物获得太阳能转化为激发态RuII*,激发态RuII*在负极上放电发生氧化反应生成RuIII,I-在电池电解质溶液中部与RuIII反应生成I3-和RuII,电解质溶液中发生反应为2Ru3++3I-=2Ru2++I3-。
A 项、由图可知,透明导电玻璃上钌(RuII)的配合物获得太阳能转化为激发态RuII*,激发态RuII*在负极上放电发生氧化反应生成RuIII,能量转化形式是太阳能先转化为化学能,化学能再转化为电能,故A错误;
B项、镀Pt导电玻璃为正极,I3-在正极上放电发生还原反应生成I-,电极反应式为I3-+2e-=3I-,故B错误;
C项、由电池工作原理可知,I3-在正极上放电发生还原反应生成I-,I-在电池电解质溶液中部与RuIII反应生成I3-和RuII,电池的电解质溶液中I-和I3-的浓度不变,故C错误;
D项、I3-在正极上放电发生还原反应生成I-,激发态RuII*在负极上放电发生氧化反应生成RuIII,I-在电池电解质溶液中部与RuIII反应生成I3-和RuII,电解质溶液中发生反应为2Ru3++3I-=2Ru2++I3-,故D正确。
故选D。


 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列叙述正确的是
A. 17g H2O2中含有非极性键的数目为NA
B. 常温常压下,17g甲基(-14CH3)所含的中子数为9NA
C. 在含CO32-总数为NA的Na2CO3溶液中,Na+总数为2NA
D. 13. 8g NO2与足量水反应,转移的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积恒为0.5 L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,其化学平衡常数K与t的关系如下表:
2NH3(g) ΔH<0,其化学平衡常数K与t的关系如下表:
t/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5(mol·L-1)-2 |
请完成下列问题:
(1)试比较K1、K2的大小,K1________K2(填“>”、“=”或“<”)。
(2)下列各项能做为判断该反应达到化学平衡状态的依据的是_____(填字母序号)。
a.容器内N2、H2、NH3的浓度之比为1∶3∶2
b.v正(N2)=3v逆(H2)
c.容器内压强保持不变
d.混合气体的密度保持不变
(3)400 ℃时,反应2NH3(g)![]() N2(g)+3H2(g)的平衡常数K为____。当测得NH3、H2、N2的物质的量分别为3 mol、1 mol、2 mol时,则该反应的v正(N2)___ v逆(N2)(填“>”、“=”或“<”)。
N2(g)+3H2(g)的平衡常数K为____。当测得NH3、H2、N2的物质的量分别为3 mol、1 mol、2 mol时,则该反应的v正(N2)___ v逆(N2)(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有0.1 mol/L的NH4HCO3溶液,pH =7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如下图所示。下列说法不正确的是

A. 常温下Kb(NH3·H2O)> Kal(H2CO3)
B. 向pH =6.5的上述溶液中逐滴滴加NaOH溶液时,NH4+和HCO3一浓度都逐渐减小
C. NH4HCO3溶液中存在下列守恒关系:c( NH4+) +c( NH3·H2O) =c(HCO3-)+c(CO3 2-)+c( H2 CO3)
D. 当溶液的pH =9时,溶液中存在下列关系:c(HCO3-)>c(NH4+>c(NH3·H2O)>c(CO3 2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 0.1 mol丙烯酸中含有的双键数目为0.1 NA
B. 标准状况下,2.24LH2O中含有的共价键数目为0.2NA
C. 6.2 g白磷分子中含P—P键为0.2 NA
D. 7.8 g Na2O2和Na2S的固体混合物中含有的离子总数为0.3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上常用AG表示溶液中的酸碱度,AG=lg![]() 。25℃时,用0.100 mol·L-1的NaOH溶液滴定20.0 mL 0.100 mol·L-1某酸(HA)溶液,AG与所加NaOH溶液的体积(V)关系如图所示,下列说法正确的是
。25℃时,用0.100 mol·L-1的NaOH溶液滴定20.0 mL 0.100 mol·L-1某酸(HA)溶液,AG与所加NaOH溶液的体积(V)关系如图所示,下列说法正确的是
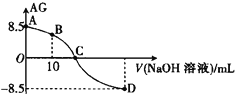
A. B点溶液中存在2c(H+)-2c(OH-)=c(A-)-c(HA)
B. C点时,加入NaOH溶液的体积大于20.00 mL
C. 滴定过程中应该选择甲基橙做指示剂
D. 25℃时,该酸HA的电离平衡常数Ka=1.0×10-5.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】瑞巴匹特为新型抗溃疡药,它可保护胃肠黏膜免受各种致溃疡因子的危害,其合成路线如下:

(1)A的化学名称为________,A与足量的NaOH溶液反应的化学方程式________。
(2)化合物D中含氧官能团的名称为________。
(3)反应①~④中,属于取代反应的是________(填序号)。
(4)C→D的转化中,生成的另一种产物为HCl,则X的结构简式为________。
(5)已知Y中的溴原子被-OH取代得到Z,写出同时满足下列条件的Z的一种同分异构体的结构简式:________。
Ⅰ.分子中含有一个苯环和一个五元环,且都是碳原子形成环;
Ⅱ.苯环上有两个取代基,且处于对位;
Ⅲ.能与NaHCO3溶液发生反应。
(6)已知:①CH3CH2OH![]() CH3CH2Br,请写出以A和HOCH2CH2CH2OH为原料制备
CH3CH2Br,请写出以A和HOCH2CH2CH2OH为原料制备![]() 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:___
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbCO3可用于油漆、陶瓷和玻璃等工业。由方铅矿(主要成分为PbS,含有杂质FeS等)和软锰矿(主要成分为MnO2)制备PbCO3的流程如下:

已知:PbCl2难溶于冷水和乙醇,易溶于热水;各物质的溶度积见下表。试回答下列问题:
物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | PbCl2 | PbS | PbCO3 |
Ksp | 2×10-13 | 8.0×10-16 | 1×10-38 | 1.6×10-5 | 8.0×10-28 | 7.4×10-14 |
(1)PbCO3的名称是________。
(2)步骤①中MnO2的作用是________,根据下图分析①的最佳反应条件是________。

(3)步骤②趁热抽滤的原因是___________________。
(4)步骤③洗涤用的试剂是____________。
(5)将滤液Y先酸化,然后加入MnO2,反应的离子方程式为__________;若反应后c(Mn2+)=0.2mol/L,进一步调节溶液的pH可分离Fe3+和Mn2+,溶液所调的pH范围为_______[c(Fe3+)≤1×10-5 mol/L时表示Fe3+已沉淀完全]。
(6)步骤④反应的离子方程式为______________。
(7)样品PbCO3中有少量PbCl2杂质,提纯的实验方案是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法符合事实的是
A.物质的量浓度相同的硫酸氢铵溶液和醋酸铵溶液中,硫酸氢铵中的铵根离子物质的量浓度较小
B.在10mL 0.1 mol/L的AgNO3溶液中加入6mL等浓度的NaCl溶液,有白色沉淀产生,再加入6 mL等浓度的Na2S溶液,溶液中又有黑色沉淀生成,说明Ksp(Ag2S)< Ksp(AgCl)
C.物质的量浓度均为0.02 mol/L的弱酸HX及其盐NaX等体积混合后:c(X-)+ c(HX)=" 0.02" mol/L
D.己知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12。在含C1-、CrO42-浓度相同的溶液中滴加AgNO3溶液时,首先生成Ag2CrO4沉淀。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com