
| A. | 标准状况下,2.24L苯中含C-C数目为0.3NA | |
| B. | 常温下9.2gNO2和N2O4的混合气体中含有的氧原子数目为0.4NA | |
| C. | 常温下,1.0LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA | |
| D. | 在反应KCO2+6HCl═KCl+3Cl2↑+3H2O中能生成转移电子数为6NA |
分析 A、标况下苯为液态;
B、NO2和N2O4的最简式均为NO2;
C、在氢氧化钠溶液中,水的电离被抑制,氢离子全部来自于水的电离;
D、反应KCO2+6HCl═KCl+3Cl2↑+3H2O中,发生了氯元素的归中反应.
解答 解:A、标况下苯为液态,故不能根据气体摩尔体积来计算其物质的量,且苯不是单双键交替的结构,即苯中不含碳碳单键,故A错误;
B、NO2和N2O4的最简式均为NO2,故9.2g混合物中含有的NO2的物质的量为n=$\frac{9.2g}{46g/mol}$=0.2mol,故含0.4mol氧原子即0.4NA个,故B正确;
C、在氢氧化钠溶液中,水的电离被抑制,氢离子全部来自于水的电离,而pH=13的氢氧化钠溶液中,氢离子浓度为10-13mol/L,故水电离出的氢离子的物质的量为
10-13mol,而水电离出的氢氧根的物质的量和氢离子的物质的量相同,故此溶液中水电离出的氢氧根的物质的量也为10-13mol,个数为10-13NA个,故C错误;
D、反应KCO2+6HCl═KCl+3Cl2↑+3H2O中,发生了氯元素的归中反应,反应转移5mol电子即5NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:选择题
| A. | c (Na+)>c (HCO3-)>c (CO32-)>c(H+)>c(OH-) | |
| B. | c (Na+)=c (HCO3-)+c (CO32-)+c (H2CO3) | |
| C. | c (Na+)=c (HCO3-) | |
| D. | c (Na+)+c(H+)=c (HCO3-)+2c (CO32-)+c(OH-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | O |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
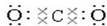 ,O=C=O.
,O=C=O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向盛有2mL0.1mol/L AgNO3溶液的试管中,先滴加几滴0.1mol/L KCl溶液,再滴加0.1mol/L KI溶液 | 先出现白色沉淀,后出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 将适量CO2和SO2分别通入装有Ba(NO3)2溶液的两支试管中 | 一支试管出现白色沉淀,另一支试管无明显现象 | 出现的白色沉淀是BaSO3 |
| C | 取少量KClO3晶体溶于适量的蒸馏水,再加入硝酸酸化的AgNO3溶液 | 产生白色沉淀 | KClO3中含Cl- |
| D | 湿润的KI淀粉试纸靠近气体Y | 试纸变蓝 | Y可能是Cl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
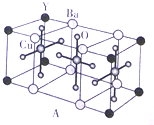 NH3称为叠氮酸,常温下为无色有刺激性气味的液体,N${\;}_{3}^{-}$也被称为类卤离子,用酸与叠氮化钠反应可制得叠氮酸,而叠氮化钠可从下列反应制得:NaNH2+N2O═NaN3+H2O,HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,溶解铜生成CuCl${\;}_{2}^{-}$.铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶泡如图,图中小黑球代表氧原子,其余大求为Y、Cu、Ba原子)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症,试回答下列问题:
NH3称为叠氮酸,常温下为无色有刺激性气味的液体,N${\;}_{3}^{-}$也被称为类卤离子,用酸与叠氮化钠反应可制得叠氮酸,而叠氮化钠可从下列反应制得:NaNH2+N2O═NaN3+H2O,HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,溶解铜生成CuCl${\;}_{2}^{-}$.铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶泡如图,图中小黑球代表氧原子,其余大求为Y、Cu、Ba原子)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症,试回答下列问题: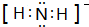 其中心原子的杂化类型是sp3
其中心原子的杂化类型是sp3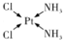 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
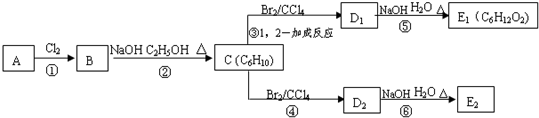
 .
.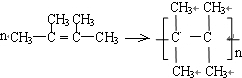 .
.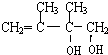 ;C的系统名称是2,3-二甲基-1,3丁二烯.
;C的系统名称是2,3-二甲基-1,3丁二烯. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯中的少量苯酚可先加适量的溴水,再过滤而除去 | |
| B. | 将苯酚晶体放人少量水中,加热时全部溶解,冷却后形成乳浊液 | |
| C. | 苯酚的酸性很弱,不能使酸碱指示剂变色 | |
| D. | 苯酚有毒,但其稀溶液可直接用作防腐剂和消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
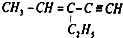 ,四面体碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数最多为b,一定在同一平面内的碳原子数最多为c,则a、b、c分别为( )
,四面体碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数最多为b,一定在同一平面内的碳原子数最多为c,则a、b、c分别为( )| A. | 3,3,6 | B. | 2,3,5 | C. | 2,5,4 | D. | 4,6,4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com