
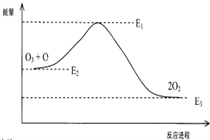
| A. | △H=△H1+△H2 | |
| B. | ClO中含有极性共价键 | |
| C. | 反应O3+O→2O2的△H=E1-E3 | |
| D. | 氯原子改变了该反应的历程,但不影响△H |
分析 A.根据盖斯定律计算O3+O→2O2 的△H;
B.Cl-O为不同原子形成的共价键,属于极性键;
C.由图可知,O+O3=2O2 的反应为放热反应,△H=E3-E2;
D.根据特征反应方向Cl原子作用.
解答 解:A.①O3+Cl→ClO+O2△H1
②ClO+O→Cl+O2△H2
根据盖斯定律①+②可得:O3+O→2O2 △H=△H1+△H2,故A正确;
B.ClO中Cl-O键为不同原子形成的化学键,为极性键,故B正确;
C.由图象曲线可知,生成物的能量低,O+O3=2O2 的反应为放热反应,则△H=E3-E2,故C错误;
D.在反应O3+Cl→ClO+O2、ClO+O→Cl+O2中,Cl原子起到了催化剂的作用,氯原子改变了该反应的历程,不影响△H,故D正确;
故选C.
点评 本题考查化学反应中的能量变化及盖斯定律,题目难度不大,明确信息及图象的分析是解答本题的关键,注意掌握盖斯定律的内容及应用方法,试题培养了学生的分析能力及灵活应用基础知识的能力.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
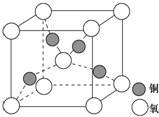 目前半导体生产展开了一场“铜芯片”革命--在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:
目前半导体生产展开了一场“铜芯片”革命--在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH3 | B. | CH3CH(CH3)2 | C. | (CH3)2CHCH2CH3 | D. | CH3C(CH3)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.1mol•L-1CH3COOH溶液中加入少量水,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$减小 | |
| B. | 向0.1mol•L-1CH3COONa溶液加入少量水,溶液中$\frac{c(CHCO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变 | |
| C. | 向盐酸中加入氨水至中性,溶液中$\frac{c(N{H}_{4}^{+})}{c(C{l}^{-})}$>1 | |
| D. | 向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中$\frac{c(Cl-)}{c(B{r}^{-})}$减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com