
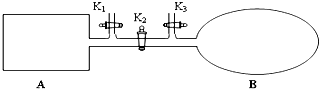
 如图所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2,将各1mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L.
如图所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2,将各1mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L.

科目:高中化学 来源: 题型:
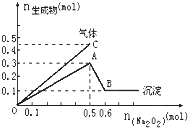 向一定量的Mg2+、NH4+、Al3+混合溶液中加入Na2O2的量与生成沉淀和气体的量(纵坐标)的关系如图所示,则溶液中Mg2+、NH4+、Al3+三种离子的物质的量之比为( )
向一定量的Mg2+、NH4+、Al3+混合溶液中加入Na2O2的量与生成沉淀和气体的量(纵坐标)的关系如图所示,则溶液中Mg2+、NH4+、Al3+三种离子的物质的量之比为( )| A、1:1:2 |
| B、2:2:1 |
| C、1:2:2 |
| D、9:2:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、丙炔 | B、乙炔 |
| C、2-丁炔 | D、2-丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用过滤的方法除去食盐水中的泥沙 |
| B、用蒸馏的方法将自来水制成蒸馏水 |
| C、用酒精萃取碘水中的碘 |
| D、用淘洗的方法从沙里淘金 |
查看答案和解析>>
科目:高中化学 来源: 题型:
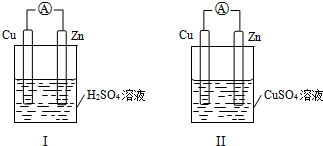
| A、装置Ⅰ,铜片上有O2逸出 |
| B、装置Ⅰ,锌片溶解,发生还原反应 |
| C、装置Ⅱ,电池反应为:Zn+Cu2+=Zn2++Cu |
| D、装置Ⅱ,外电路中,电子从铜电极流向锌电极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com