
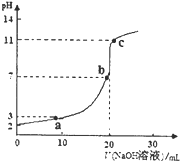
 室温时,将0.10mol?L-1 NaOH溶液滴入20.00mL未知浓度的某一元酸HA溶液中,溶液pH随加入NaOH溶液体积变化曲线如图.下列有关说法不正确的是( )
室温时,将0.10mol?L-1 NaOH溶液滴入20.00mL未知浓度的某一元酸HA溶液中,溶液pH随加入NaOH溶液体积变化曲线如图.下列有关说法不正确的是( )| A、该一元酸溶液浓度为0.10mol?L-1 |
| B、a、b、c点的水溶液导电性依次增强 |
| C、室温时,HA的电离常数Ka≈1×10-5 |
| D、a点和c点所示溶液中H2O的电离程度相同 |
| [H+]?[A-] |
| [HA] |
| [H+]?[A-] |
| [HA] |
| (0.01)2 |
| 0.1-0.01 |


科目:高中化学 来源: 题型:
| A、使用太阳能热水器、沼气的利用、玉米制乙醇都涉及到生物质能的利用 |
| B、石油、煤、天然气、可燃冰、植物油都属于化石燃料 |
| C、向汽油中添加甲醇后,该混合燃料的热值不变 |
| D、利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水加热到很高的温度都难分解是因为水分子中存在氢键 |
| B、蔗糖、淀粉、蛋白质及其水解产物均为非电解质 |
| C、在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
| D、不用任何试剂即可鉴别Na2CO3溶液和NaHSO4溶液. |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 草酸二乙酯可用于苯巴比妥等药物的中间体,实验室以草酸(HOOC-COOH)和乙醇为原料制备草酸二乙酯的实验步骤如下:
草酸二乙酯可用于苯巴比妥等药物的中间体,实验室以草酸(HOOC-COOH)和乙醇为原料制备草酸二乙酯的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量暗红色固体样品放在试管中,加入足量的锡氨水,震荡、静置 | ② | 假设3成立 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com