
| A. | 只有①②③ | B. | 只有①②④ | C. | 只有①③④ | D. | ①②③④ |
分析 ①不能在容量瓶中稀释浓硫酸;
②滴加液体时,胶头滴管悬空正放;
③闻未知气体气味时,用手轻轻扇动,使极少量气体进入鼻孔;
④熄灭酒精灯时,用灯冒盖灭.
解答 解:①不能在容量瓶中稀释浓硫酸,应在烧杯中稀释、冷却后转移到容量瓶中定容,故错误;
②滴加液体时,胶头滴管悬空正放,防止试剂污染,故错误;
③闻未知气体气味时,用手轻轻扇动,使极少量气体进入鼻孔,不能直接把集气瓶盖打开,放在鼻子下闻,防止中毒,故错误;
④熄灭酒精灯时,用灯冒盖灭,不能用扇子扇灭,也不能用嘴吹灭,防止失火,故错误;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握实验基本操作、实验安全、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:实验题
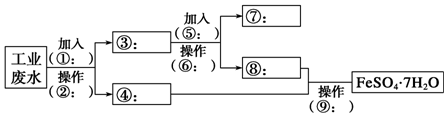
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
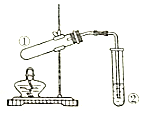
| 选项 | ①中试剂 | ②中溶液 | 实验目的 |
| A | 二氧化锰(s),浓盐酸 | 饱和食盐水 | 制取氯气 |
| B | Na2SO3(s),70%H2SO4 | 酸性高锰酸钾 | 验证SO2的还原性 |
| C | Na2CO3(s)或NaHCO3(s) | 澄清石灰水 | 鉴别Na2CO3和NaHCO3 |
| D | 乙醇、乙酸、浓硫酸 | 饱和碳酸钠 | 制取乙酸乙酯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NH4HSO3溶液中,加入过量的氢氧化钠溶液,并加热:NH4++OH- $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| B. | 向FeBr2溶液中通入过量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| C. | FeCl3溶液与Cu的反应:Cu+2Fe3+=Cu2++2Fe2+ | |
| D. | 向次氯酸钠溶液中通入少量SO2气体:2ClO-+SO2+H2O=2HClO+SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焰色反应与电子跃迁有关 | |
| B. | P4和CH4都是正四面体分子且键角都为109°28′ | |
| C. | 元素电负性越大的原子,吸引电子的能力越强 | |
| D. | 根据对角线规则,H3BO3是弱酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以惰性电极电解饱和食盐水阴极:Na++e-═Na | |
| B. | 用铜电极电解CuSO4溶液)阳极:Cu═Cu2++2e- | |
| C. | 以惰性电极电解熔融NaCl阴极:Na++e-═Na | |
| D. | 以惰性电极电解NaOH溶液阳极:4OH-═2H2O+O2↑+4e- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 25mL 0.5mol/L HCl溶液 | B. | 200mL 0.5mol/L KCl溶液 | ||
| C. | 50mL 1mol/L NaCl溶液 | D. | 100mL 0.5mol/L MgCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na$→_{点燃}^{O_{2}}$Na2O$\stackrel{H_{2}O}{→}$NaOH | |
| B. | FeS2$→_{煅烧}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | SiO2$\stackrel{NaOH溶液}{→}$Na2SiO3溶液$\stackrel{盐酸}{→}$H2SiO3 | |
| D. | MgCO3$\stackrel{盐酸}{→}$MgCl2溶液$\stackrel{点解}{→}$Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com