
 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.请回答下列问题:分析 (1)气态水的能量比较液态水的能量高;
已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ/mol
②CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(g)△H=-192.9kJ/mol.
水的气化热为44kJ/mol,可得:
③H2O(l)=H2O(g)△H=+44kJ/mol
根据盖斯定律,(②-①÷3)-③可得:H2(g)+$\frac{1}{2}$O2(g)=H2O(l);
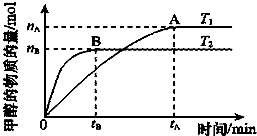
(2)温度T2先达到平衡,则温度T2>T1,又温度高时平衡状态CH3OH的物质的量少,则说明升高温度,可逆反应CO2+3H2?CH3OH+H2O向逆反应方向移动;
CO2转化率为a,转化的二氧化碳为amol,则:
CO2 (g)+3H2(g)=CH3OH(g)+H2O(g)
起始(mol):1 3 0 0
变化(mol):a 3a a a
平衡(mol):1-a 3-3a a a
相同条件下,气体的压强之比等于物质的量之比.
解答 解:(1)表示甲醇燃烧热,应是去mol甲醇燃烧生成二氧化碳与液态水,由于气态水的能量比较液态水的能量高,故生成液态水放出的热量更多,故CH3OH(g)的燃烧热大于192.9kJ/mol,
已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ/mol
②CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(g)△H=-192.9kJ/mol.
水的气化热为44kJ/mol,可得:
③H2O(l)=H2O(g)△H=+44kJ/mol
根据盖斯定律,(②-①÷3)-③可得:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-124.6kJ/mol,
故答案为:大于;H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-124.6kJ/mol;
(2)温度T2先达到平衡,则温度T2>T1,又温度高时平衡状态CH3OH的物质的量少,则说明升高温度,可逆反应CO2+3H2?CH3OH+H2O向逆反应方向移动,故正反应为放热反应;
CO2转化率为a,转化的二氧化碳为amol,则:
CO2 (g)+3H2(g)=CH3OH(g)+H2O(g)
起始(mol):1 3 0 0
变化(mol):a 3a a a
平衡(mol):1-a 3-3a a a
相同条件下,气体的压强之比等于物质的量之比,则容器内的压强与起始压强之比为=(1-a+3-3a+a+a):(1+3)=(2-a):2,
故答案为:放热;(2-a):2.
点评 本题主要考查了燃烧热、盖斯定律应用、化学平衡图象、化学平衡计算等,难度中等,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积/mL | 标准碘溶液体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 平均值 | ||
| 1 | 25.00 | 0.00 | 14.97 | ① |
| 2 | 25.00 | 0.10 | 15.13 | |
| 3 | 25.00 | 0.22 | 14.93 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
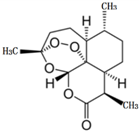 2015年10月,中国女药学家屠呦呦因创制新型抗疟药--青蒿素和双氢青蒿素的贡献,与另外两位科学家共享2015年度诺贝尔生理学或医学奖.这是中国生物医学界迄今为止获得的世界级最高级大奖.青蒿素的键线式化学结构如图所示,下列说法不正确的是( )
2015年10月,中国女药学家屠呦呦因创制新型抗疟药--青蒿素和双氢青蒿素的贡献,与另外两位科学家共享2015年度诺贝尔生理学或医学奖.这是中国生物医学界迄今为止获得的世界级最高级大奖.青蒿素的键线式化学结构如图所示,下列说法不正确的是( )| A. | 青蒿素属于芳香化合物,能与H2发生加成反应 | |
| B. | 青蒿素能与氢氧化钠溶液发生反应 | |
| C. | 青蒿素的化学式为C15H22O5 | |
| D. | 青蒿素的核磁共振谱图中有12个峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.6mol | B. | 1mol | C. | 1.3mol | D. | 0.8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
减少氮的氧化物在大气中的排放是环境保护的重要内容之一.| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
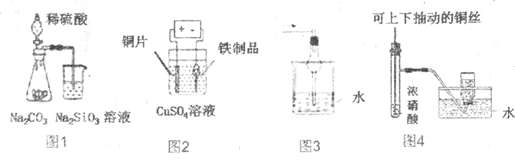
| A. | 图1为证明非金属性强弱:S>C>Si | |
| B. | 图2为在铁制品表面镀铜 | |
| C. | 图3可用于吸收氯化氢、溴化氢等气体 | |
| D. | 图4为制备并收集少量NO2气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com