
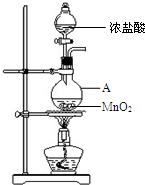
 研究小组用下图装置制取Cl2,证明产生的气体中含有HCl.
研究小组用下图装置制取Cl2,证明产生的气体中含有HCl.| 实验序号 | 试剂 | 现象 |
| a | 紫色石蕊溶液 | |
| b | AgNO3溶液 | 出现白色沉淀 |
| ||
| ||
 HCl+HClO,Cl2溶于水后使得溶液中的c(Cl-)增大,抑制了氯化钠的溶解,故也有晶体析出;
HCl+HClO,Cl2溶于水后使得溶液中的c(Cl-)增大,抑制了氯化钠的溶解,故也有晶体析出; HCl+HClO,Cl2溶于水后使得溶液中的c(Cl-)增大,也能析出晶体;
HCl+HClO,Cl2溶于水后使得溶液中的c(Cl-)增大,也能析出晶体; HCl+HClO,生成1 mol HClO需消耗1 mol Cl2,HClO也有氧化性,1 mol HClO和1 mol Cl2均能将2 mol KI氧化成I2;
HCl+HClO,生成1 mol HClO需消耗1 mol Cl2,HClO也有氧化性,1 mol HClO和1 mol Cl2均能将2 mol KI氧化成I2;

 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液不呈红色 | 稀HNO3不能将Fe氧化为Fe3+ |
| B | 向一定浓度的Na2SiO3溶液中通入适量CO2气体 | 出现白色沉淀 | H2SiO3的酸性比H2CO3的酸性强 |
| C | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和AgNO3溶液 | 均有固体析出 | 蛋白质均发生变性 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通过浓硫酸除去HCl中的H2O |
| B、通过灼热的CuO除去H2中的CO |
| C、通过灼热的镁粉除去N2中的O2 |
| D、通过水除去CO中的CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
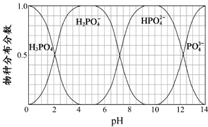 磷和砷是同主族的非金属元素.
磷和砷是同主族的非金属元素.查看答案和解析>>
科目:高中化学 来源: 题型:
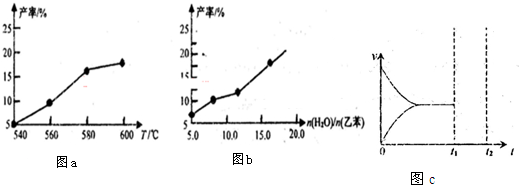
| n(H2O) |
| n(乙苯) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3CH2CH2CH3的二氯取代产物只有5种结构 |
| B、油脂的种类很多,但它们水解后都有一相同产物 |
| C、乙烯、苯、纤维素均属于烃类化合物 |
| D、苯和乙烯都能使溴水层褪色,均与溴水发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com