
| A、③①④② | B、①②③④ |
| C、③②①④ | D、①④③② |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、4 OH--4e-=2H2O+O2↑ |
| B、2H++2e-=H2↑ |
| C、2H2O+O2+4e-=4 OH- |
| D、Fe-2e-=Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、自然界中存在大量的单质硅 |
| B、石英、水晶、硅石的主要成份都是二氧化硅 |
| C、二氧化硅的化学性质活泼、溶于水形成难溶的硅酸 |
| D、自然界的二氧化硅都存在在水晶矿中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
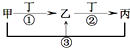 甲、乙、丙、丁是中学化学常见的物质,其中甲、乙、丙均含有同一种元素,在一定条件下的转化关系如图,下列正确的是( )
甲、乙、丙、丁是中学化学常见的物质,其中甲、乙、丙均含有同一种元素,在一定条件下的转化关系如图,下列正确的是( )| A、若丁为化合物,且为氯碱工业的重要产品,则甲的颜色反应可以呈紫色 | ||||
B、若通常情况下甲、乙、丙、丁都是气体,且乙和丁为空气的主要成分,则反应①的化学方程式4NH3+5O2
| ||||
| C、若甲、乙、丙的溶液显碱性,丙常做治疗胃酸过多的药物,则将丙溶液蒸干可制得甲 | ||||
| D、若丁为用量最大,用途最广的金属单质,乙的溶液一定为FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1×10-7 mol/L |
| B、1×107 mol/L |
| C、0.1mol/L |
| D、0.01 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol铁与0.1mol氯气点燃完全反应,转移电子数为0.3NA |
| B、0℃,101kPa时,NA个分子所占的体积一定为22.4L |
| C、1 mol?L-1K2SO4溶液中含有钾离子数为2NA |
| D、常温常压下,6.4g氧气和臭氧混合气体中含有的原子总数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某兴趣小组利用如图所示装置进行实验,对钢铁的电化学腐蚀原理进行探究.
某兴趣小组利用如图所示装置进行实验,对钢铁的电化学腐蚀原理进行探究.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com