随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO
2)排放量减少8%,氮氧化物(NO
x)排放量减少10%.目前,消除大气污染有多种方法.
(1)处理NO
2的一种方法是利用氨气催化还原法将NO
2还原为N
2.反应中每转移1.2mol电子,消耗的NO
2在标准状况下的体积为
L.
(2)处理NOx的另一种方法是利用甲烷催化还原NOx.已知:
CH
4(g)+4NO
2(g)=4NO(g)+CO
2(g)+2H
2O(g)△H=-574kJ?mol
-1CH
4(g)+4NO(g)=2N
2(g)+CO
2(g)+2H
2O(g)△H=-1160kJ?mol
-1则甲烷直接将NO
2还原为N
2的热化学方程式为
.
(3)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2NO(g)+2CO(g)?N
2(g)+2CO
2(g);△H<0.
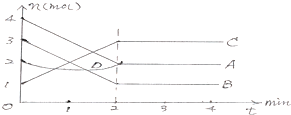
①若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图1所示.若保持温度不变,20min时再向容器中充入CO、N
2各0.6mol,平衡将
移动(填“向左”、“向右”或“不”).
②20min时,若改变反应条件,导致N
2浓度发生如图所示的变化,则改变的条件可能是
(填序号).
A.加入催化剂 B.降低温度 C.缩小容器积 D.增加CO
2的量
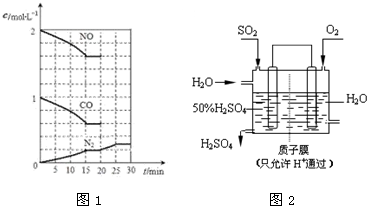
(4)设想以如图所示装置用电化学原理去除SO
2并生产硫酸,写出通入SO
2的电极的电极反应式
.
若通入H
2O的速率为13.4mL?min
-1,为稳定持续生产,硫酸溶液的浓度应维持不变,则左侧SO
2的流入速率(标准状况)应为
L?min
-1(5)NO
2可用氨水吸收生成NH
4NO
3来消除污染.25℃时,将amol NH
4NO
3溶于水,向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将
(填”正向”“不”或“逆向”)移动,所滴加氨水的浓度为
mol?L
-1.(NH
3?H
2O的电离平衡常数Kb=2×10
-5mol?L
-1)




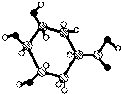 则该有机物能发生消去反应和氧化反应
则该有机物能发生消去反应和氧化反应