
����Ŀ��ֱ���ŷź�SO2���������γ����꣬Σ�������������Ƽ�ѭ�������ѳ������е�SO2��
��1���û�ѧ����ʽ��ʾSO2�γ�����������ķ�Ӧ��______________��
��2�����Ƽ�ѭ�����У�Na2SO3��Һ��Ϊ����Һ������NaOH��Һ����SO2�Ƶã��÷�Ӧ�����ӷ���ʽ��________________________
��3������Һ����SO2�Ĺ����У�pH��n(SO3��):n(HSO3��)�仯��ϵ���±�:
n(SO��)��n(HSO��) | 91��9 | 1��1 | 1��91 |
pH | 8.2 | 7.2 | 6.2 |
���ϱ��ж�NaHSO3��Һ��______�ԣ��û�ѧƽ��ԭ�����ͣ�____________��
��������Һ������ʱ����Һ������Ũ�ȹ�ϵ��ȷ����(ѡ����ĸ)��____________
a��c��Na����=2c��SO32-����c��HSO3������
b��c��Na����> c��HSO3����> c��SO32-��>c��H����=c��OH����
c��c��Na����+c��H����= c��SO32-��+ c��HSO3����+c��OH����
(4)������Һ��pH����ԼΪ6ʱ����������������������ʾ��ͼ���£�
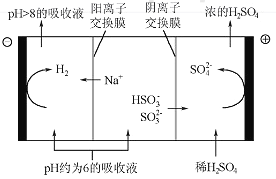
��HSO3-�������ŵ�ĵ缫��Ӧʽ��_______________��
��������������Һp������8����ʱ������Һ������ѭ�����á���������ԭ����__________
���𰸡�SO2+H2O![]() H2SO3��2 H2SO3+O2
H2SO3��2 H2SO3+O2![]() 2H2SO4 SO2+2OH- =SO32-+H2O �� HSO3�����ڣ�HSO3��
2H2SO4 SO2+2OH- =SO32-+H2O �� HSO3�����ڣ�HSO3��![]() SO32-+H����HSO3��+H2O=H2SO3+OH����HSO3���ĵ���̶�ǿ��ˮ��̶� ab HSO3-+H2O-2e- =3H++SO42- H+�������õ�������H2����Һ�е�c��H�������ͣ���ʹHSO3-��������SO32-����Na+���������ң�����Һ��������
SO32-+H����HSO3��+H2O=H2SO3+OH����HSO3���ĵ���̶�ǿ��ˮ��̶� ab HSO3-+H2O-2e- =3H++SO42- H+�������õ�������H2����Һ�е�c��H�������ͣ���ʹHSO3-��������SO32-����Na+���������ң�����Һ��������
��������
��1��SO2�ڿ����б���������ΪSO3��SO3��ˮ��Ӧ�������ᣬҲ������SO2�Ⱥ�ˮ��Ӧ���������ᣬ�����ᱻ��������Ϊ���ᡣ
��2��������SO2��NaOH��Һ��Ӧ����Na2SO3��
��3������n(SO2-)��n(HSO-)=1:91ʱ��Һ��pH=6.2��֪NaHSO3��Һ�����ԣ�ԭ����HSO-�ĵ���̶ȴ�����ˮ��̶ȡ����ݵ���غ㡢�ͱ������ݿ��ж�Ũ�ȹ�ϵ��
(4)�����У�������HSO-ʧȥ��������SO42-��ͬʱ����H+������ϡ����Ũ��������������ˮ�����H+�õ�����������������Һ��OH-Ũ������HSO-��Ӧ����SO32-����Na+���������ң�ʹ����Һ����������
��1��SO2�γ�����������ʱ����������Ϳ����е�ˮ��������Ӧ�õ����SO2+H2O![]() H2SO3��2 H2SO3+O2
H2SO3��2 H2SO3+O2![]() 2H2SO4��
2H2SO4��
��2��������������������Һ�����Ʊ�����������Һʱ��SO2+2OH- =SO32-+H2O��
��3�����ݱ������ݣ���֪��n(SO3��):n(HSO3��)=1:91ʱ����Һ��pHֵΪ���ԣ���NaHSO3��Һ�����ԣ���������������Һ��HSO3�����ڣ�HSO3��![]() SO32-+H����HSO3��+H2O=H2SO3+OH����HSO3���ĵ���̶�ǿ��ˮ��̶ȣ�����Һ�����ԡ�������Һ������ʱ����Һ�е�c��H����=c��OH������������Һ�д����ŵ���غ㣬��c��Na����+c��H����=2c��SO32-��+ c��HSO3����+c��OH���������Ƴ���c��Na����=2c��SO32-����c��HSO3������a��ȷ������n(SO��):n(HSO��)=1��1ʱ����Һ��pHֵΪ7.2��������ʱһ����c��HSO3����> c��SO32-�������Ƴ���c��Na����> c��HSO3����> c��SO32-��>c��H����=c��OH������b��ȷ��c�����ϵ���غ㡣��ѡab��
SO32-+H����HSO3��+H2O=H2SO3+OH����HSO3���ĵ���̶�ǿ��ˮ��̶ȣ�����Һ�����ԡ�������Һ������ʱ����Һ�е�c��H����=c��OH������������Һ�д����ŵ���غ㣬��c��Na����+c��H����=2c��SO32-��+ c��HSO3����+c��OH���������Ƴ���c��Na����=2c��SO32-����c��HSO3������a��ȷ������n(SO��):n(HSO��)=1��1ʱ����Һ��pHֵΪ7.2��������ʱһ����c��HSO3����> c��SO32-�������Ƴ���c��Na����> c��HSO3����> c��SO32-��>c��H����=c��OH������b��ȷ��c�����ϵ���غ㡣��ѡab��
��4�����ݵ�����ʾ�ı仯����֪HSO3-�������ŵ�ĵ缫��Ӧʽ�ǣ�HSO3-+H2O-2e- =3H++SO42-��


 �ŵ������ϵ�д�
�ŵ������ϵ�д� 53������ϵ�д�
53������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�NO2��SO2 ��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���塣
��1��NO2����ˮ���գ���Ӧ�Ļ�ѧ��Ӧ����ʽΪ____________________________________________�����÷�Ӧ6NO2�� 8NH3![]() 7N2��12H2OҲ�ɴ���NO2����ת��1.2mol����ʱ�����ĵ�NO2�ڱ�״������___________L��
7N2��12H2OҲ�ɴ���NO2����ת��1.2mol����ʱ�����ĵ�NO2�ڱ�״������___________L��
��2����֪��2SO2(g)+O2(g)![]() 2SO3(g) ��H����196.6 kJ��mol-1
2SO3(g) ��H����196.6 kJ��mol-1
2NO(g)+O2(g)![]() 2NO2(g) ��H����113.0 kJ��mol-1
2NO2(g) ��H����113.0 kJ��mol-1
��ӦNO2(g)+SO2(g)![]() SO3(g)+NO(g)�� ��H��_____________kJ��mol-1��
SO3(g)+NO(g)�� ��H��_____________kJ��mol-1��
һ�������£���NO2��SO2�������1��2�����ܱ������з���������Ӧ�����ƽ��ʱNO2��SO2�����Ϊ1��6����ƽ�ⳣ��K��_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2008�꣬��¹�ȶ������Ʒ��ҵΪʹ�����ʺ������ϸ�����������谷��ʹ������ͯ������ʯ��ʵ���ҿ�������ʵ��װ�òⶨ�����谷�ķ���ʽ��

��֪�����谷����Է�������Ϊ126��ȡ1.26 g�����谷��Ʒ�����ڴ����г��ȼ�գ����ɶ�����̼��ˮ��������ʵ����װ��B����0.54g��C����1.32g������F��ˮ�����Ϊ672 mL(�ɰ���״������)��
��1��Eװ�õ�������_____��
��2����Ҫ���ȵ�װ����____(����ĸ����)��
��3��װ��D��������_____��
��4��F������ʱӦ��ע�����____��_____��
��5�������谷�ķ���ʽΪ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧУ��ѧ��ȤС��Ϊ̽��������������ۺ����ã�ר�����ʵ���ú�����������ͭ�ĺϽ���ȡ�������Ȼ�����Һ���̷�����(FeSO4��7H2O)�͵�������(CuSO4��5H2O)����ʵ�鷽�����£�
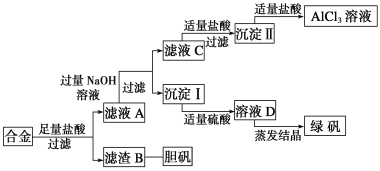
��ش��������⣺
(1)�����õIJ���������___________________________________________________��
(2)����ҺCת��Ϊ������Ĺ�������������������ƣ��ɸ�ΪͨCO2���壬д����ҺC��ͨ�����CO2�����ӷ���ʽ��______________________________________________��
д���ɳ�����ת��ΪAlCl3��Һ�����ӷ���ʽ��_____________________________��
(3)С���Ա������⣬�����Ƶõ��̷��������Է�������Ҫ������Щ���ʣ�_______________________________��Ҫ���ɳ����������Ƶô��Ƚϸߵ��̷���Ӧ��θĽ�___________________________________
(4)С���Ա�������л�֪H2O2��һ����ɫ��������������B�м���ϡ�����H2O2���Ʊ��������壬��÷�Ӧ���ܻ�ѧ����ʽΪ_______________________________��
(5)��ͬѧ����ɽ�����������ܽ�Ͻ�������Ϊ�ռ������Ʒ�����Ҳ�������Ƶ��������ʣ�����Ϊ�ڶ��ַ�������ڵ�һ�ַ���________(������������������������)��������________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������֮���ת����ͼ��ʾ��
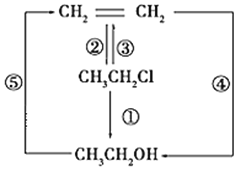
(1)д������Ӧ�Ļ�ѧ����ʽ��_________����_________����__________��
(2)������������ʽ�ش��������⣺
A.������ѧ��Ӧ�ķ�Ӧ������__________��__________��__________��
B.��AgNO3��Һͨ��__________��Ӧ��֤��±�����к�±Ԫ�ء�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳ���ˮ��������ķ���(����װ����ͼ)��ֲ����֯�л�ȡ�ӷ��Գɷ֡���Щ�ӷ��ԳɷֵĻ����ͳ�ƾ��ͣ���������������ζ�������ʡ����Ӻ����ӵ�ˮ���Ĺ�Ƥ����ȡ�ľ���90%����������ϩ����ȡ����ϩ��ʵ������������£�����ϩ![]()
�ٽ�12������Ƥ����ϸ�����Ƭ��Ͷ����װ���У�����Լ30mLˮ,
���ɿ�����K������ˮ������������ˮ���ڣ�����K��֧�ܿ��д���ˮ����ð��ʱ������ ������ˮ��ˮ��������ʼ���У��ɹ۲쵽�����Һ��ˮ������һ��ܱ����Ͳ㡣����˵������ȷ����
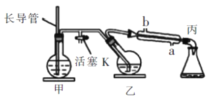
A.�����Һ���������飬������ʱ��˵���������
B.Ϊ�ﵽʵ��Ŀ�ģ�Ӧ�����еij����ܻ����¶ȼ�
C.����������Ȱ����еĵ����ܴ���Һ���Ƴ�����ֹͣ����
D.Ҫ�õ������ͣ�����Ҫ�õ����·����ᴿ��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��3�����ʽṹ������]̼���仯����㷺��������Ȼ���У��ش��������⣺
��1������һ���ռ��˶�״̬�ĵ�����ԭ�Ӻ�����ֵĸ����ܶȷֲ�����___________�����������ڻ�̬ԭ���У��������______�������෴�ĵ��ӡ�
��2��̼���γɻ�����ʱ��������Թ��ۼ�Ϊ����ԭ����_____________��
��3��CS2�����У����ۼ���������_____________��Cԭ�ӵ��ӻ����������_______��д��������CS2������ͬ�ռ乹�ͺͼ�����ʽ�ķ��ӻ�����_______________��
��4��CO�������Fe�γ�Fe(CO)5���û�������۵�Ϊ253K���е�Ϊ376K�����������_____���塣
̼�ж���ͬ�������壬����ʯīϩ����ʯ�ľ���ṹ��ͼ��ʾ��

����ʯīϩ�����У�ÿ��Cԭ������_____����Ԫ����ÿ����Ԫ��ռ��___��Cԭ�ӡ�
���ڽ��ʯ�����У�Cԭ�������ӵ���С��ҲΪ��Ԫ����ÿ��Cԭ������________����Ԫ������Ԫ���������________��Cԭ����ͬһƽ�档
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��һ����ɫ�����ĩ����ΪNa2CO3��NaHCO3���е�һ�֣������ʵ��ȷ���ð�ɫ��ĩ�ijɷ�________________________________________��
(2)ijͬѧ����CO32-�������ô�����Һ����̪�Լ����Ȼ�����Һ�������һ��̽��������Һ�ʼ�������CO32-�������ʵ�鷽������Ҫʵ�鲽�輰ʵ������Ϊ��
�� CO32-ˮ������ӷ�Ӧ����ʽΪ____________________________________________��
�� ȡ�����Ȼ�����Һ�����̪�������ɫ��˵����_____________________________��
�� ȡ����̼������Һ�������̪���Ժ�ɫ���ټ����Ȼ�����Һ������Ϊ��____________________________��˵��_____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ��ʵ��ó��Ľ�����ȷ����![]()
A.��������ȫ����ˮ���μ�ϡ���ᣬ���ְ�ɫ��������ù����д���![]()
B.����������ˮ���ٵμ������������ְ�ɫ�������������ΪHCl
C.��ij��ɫ��Һ��NaOH��Һ�����ȣ���ʪ�����ɫʯ����ֽ�����Թܿڣ�����ֽ��죬��˵��ԭ��Һ��һ����![]()
D.��ij��ɫ��Һ�еμ�NaOH��Һ��������ɫ�����������Һ�п��ܴ���![]()
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com