
| A. | CaCl2溶液 | B. | 澄清石灰水 | C. | 稀盐酸 | D. | 酚酞溶液 |
 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:选择题
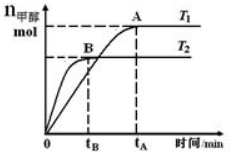 在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示.下列说法正确的是( )
在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示.下列说法正确的是( )| A. | CO合成甲醇的反应为吸热反应 | |
| B. | 该反应在T1时的平衡常数比T2时的大 | |
| C. | 平衡常数K=$\frac{c(CO)•{c}^{2}({H}_{2})}{c(C{H}_{2}OH)}$ | |
| D. | 处于A点的反应体系从T1变到T2,达到平衡时$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.3 mol/(L•s) | B. | v(B)=0.5 mol/(L•s) | C. | v(C)=0.8 mol/(L•s) | D. | v(D)=1 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Fe2+、SO32- | B. | Na+、K+、SO42- | C. | K+、SO42-、OH- | D. | Al3+、NO3-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
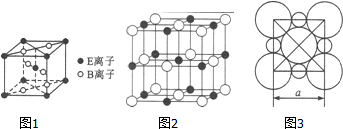 A、B、C、D、E五种常见元素的核电荷数依次增大.A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态3d轨道上有2个电子.请回答下列问题:
A、B、C、D、E五种常见元素的核电荷数依次增大.A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态3d轨道上有2个电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①③④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热23.15 kJ |
| ② | 0.6 | 1.8 | 0.8 | Q(Q>0) |
| A. | 容器①、②中反应的平衡常数相等 | |
| B. | 达平衡时,两个容器中XY3的物质的量浓度均为1mol•l-1 | |
| C. | 容器②中反应达到平衡时放出的热量为Q | |
| D. | 若将容器①体积缩小为0.40 L,则达平衡时放出的热量大于23.15 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com