
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SiCl4、PCl5分子中各原子最外层均达到8电子稳定结构 |
| B.化学反应中能量变化的大小与反应物的质量多少无关。 |
| C.经实验测得邻-二溴苯仅一种结构,说明苯环结构中,不存在单双键交替结构 |
| D.需要加热才能发生的反应一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 O)4和 [Cu(NH3)4]2+,[Fe(SCN)]2+配合物离子中,提供空轨道接受孤对电子的原子或离子分别是:_______________、___________、___ __________。
O)4和 [Cu(NH3)4]2+,[Fe(SCN)]2+配合物离子中,提供空轨道接受孤对电子的原子或离子分别是:_______________、___________、___ __________。 ,BCl3的空间构型为:___________
,BCl3的空间构型为:___________ 子
子 的化学式:(只需写一种)
的化学式:(只需写一种)查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.联氨(N2H4)结构与C2H4相似,存在N=N双键 | |
| B.一分子联氨中含有的电子对数目为5 | C.联氨中的N原子的杂化类型为sp3杂化 |
| D.联氨能与HCl发生化合反应生成N2H6Cl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 |
B.乳酸(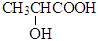 )存在对映异构体,因为其分子中含有一个手性碳原子 )存在对映异构体,因为其分子中含有一个手性碳原子 |
C.在NH3分子中存在极性共价键和配位键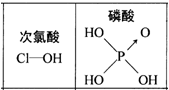 |
| D.由上图知酸性:H3PO4>HClO,因为H3PO4分子中有非羟基氧原子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 物质 | Na2O | NaCl | AlF3 | AlCl3 | BCl3 | Al2O3 | CO2 | SiO2 |
| 熔点 | 920 | 801 | 1291 | 190 | —107 | 2073 | —57 | 1723 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 们的电子总数均为14。
们的电子总数均为14。 原子分子或离子。
原子分子或离子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com