
【题目】在一定条件下,某容器中充入N2和H2合成NH3,以下叙述错误的是( )
A.开始反应时,正反应速率最大,逆反应速率为零
B.随着反应的进行,正反应速率逐渐减小,最后减小为零
C.随着反应的进行,逆反应速率逐渐增大,最后保持恒定
D.随着反应的进行,正反应速率逐渐减小,最后与逆反应速率相等且都保持恒定
科目:高中化学 来源: 题型:
【题目】下列溶液加热蒸干后并灼烧,能析出溶质固体本身的是:( )
A. AlCl3溶液 B. KHCO3溶液 C. Fe2(SO4)3溶液 D. NH4HCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的说法正确的是
A. 皂化反应的产物是高级脂肪酸和甘油
B. 新戊烷与2—甲基丁烷为同一种物质
C. 酯化反应和酯的水解反应均为取代反应
D. 将苯与浓溴水混合能制取溴苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流储能电池利用不同价态离子对的氧化还原反应来实现化学能和电能的相互转化,充电时,惰性电极M、N分别连接电源的正极和负极。电池工作原理如图所示,下列说法不正确的是 ( )
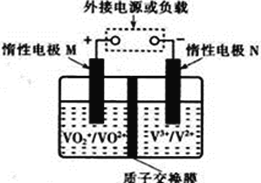
A. 充电过程中,N电极附近酸性减弱
B. 充电过程中,N电极上V3+被还原为V2+
C. 放电过程中,H+由N电极向M电极移动
D. 放电过程中,M电极反应为VO2++ 2H++e-= VO2+ +H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合物0.1mol完全燃烧得0.16mol二氧化碳和3.6克水。下列说法正确的是
A.一定有甲烷 B.一定是甲烷和乙烯 C.可能有乙烷 D.一定有乙炔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铝土矿(主要成分为Al2O3和杂质)为原料制备铝的一种工艺流程如下:

注:反应Ⅰ“碱溶”时杂质转化为沉淀
(1)反应Ⅰ,发生反应生成偏铝酸钠的离子方程式__________。
(2)电解Ⅰ是电解熔融的冰晶石和Al2O3的混合物,电解过程中作阳极的石墨易消耗,原因是___________。
(3)反应Ⅱ,用一定浓度的NaHCO3溶液处理过滤Ⅰ后的滤液,所得溶液pH和生成Al(OH)3的量随加入NaHCO3溶液体积变化的曲线如下:

①加入NaHCO3溶液体积小于8 mL时,发生主要反应的离子方程式__________。
②反应Ⅱ中生成Al(OH)3的离子方程式__________。
(4)电解Ⅱ是电解Na2CO3溶液,得到含NaHCO3的阳极液,原理如下图所示。

阴极产生的物质A的化学式为____________。
(5)以铝材为阳极,在H2SO4溶液中电解,可在铝材表面形成致密氧化膜,阳极电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C14H10O4常用的油脂、蜡的漂白剂、化妆品助剂、橡胶硫化剂。下面是以物质A为原料合成C14H10O4的流程:
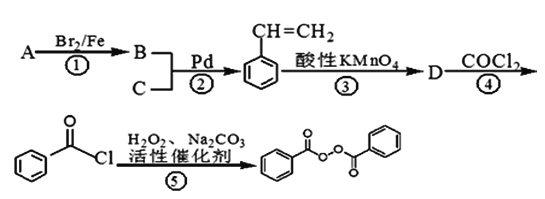
提示:①2010年赫克、根岸英一和铃木章因在“钯催化交叉偶联反应”研究领域作出了杰出贡献,而获得了诺贝尔化学奖,其反应机理可简单表示为: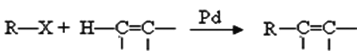
②苯乙烯和甲苯与酸性KMnO4溶液反应产物相同。
请回答下列问题:
(1)物质A的分子式为_________,物质C中含有的官能团的名称为________,D的结构简式为___________;
(2)反应①~④中属于取代反应的有________________;
(3)反应②的化学反应方程式___________________________________;
(4)某物质E为漂白剂(C14H10O4,)的同分异构体,同时符合下列条件的E的同分异构体有___种;
①含有联苯结构单元(![]() ),在一定条件下能发生银镜反应,且1molE最多可消耗4mol NaOH
),在一定条件下能发生银镜反应,且1molE最多可消耗4mol NaOH
②遇FeCl3溶液不显紫色,且苯环上核磁共振氢谱有六个吸收峰.
(5)请写出以苯乙烯和乙烯为原料,合成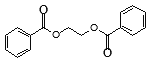 的流程,无机物任选,注明反应条件_____________。
的流程,无机物任选,注明反应条件_____________。
示例如下: 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com