
【题目】一种利用电解锰阳极泥(主要成分MnO2、MnO)制备MnO2的工艺流程如下:
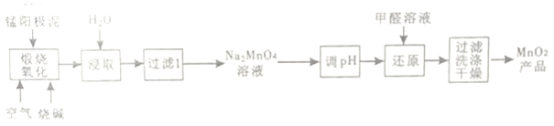
(1)“煅烧氧化”时,1mol MnO煅烧完全转化为Na2MnO4失去电子的物质的量为___________;MnO2煅烧反应的化学方程式为__________________。
(2)“浸取”时,为提高Na2MnO4的浸取率,可采取的措施有____________、____________(列举2点)
(3)“调pH”是将溶液pH 调至约为10,防止pH较低时Na2MnO4自身发生氧化还原反应,生成MnO2和___________;写出用pH试纸测定溶液pH的操作_______________。
(4)“还原”时有无机含氧酸盐生成,发生反应的化学方程式为_____________。
(5)测定产品中MnO2质量分数的步骤如下:
步骤1. 准确称取mg产品,加入c1mol·L-1Na2C2O4溶液V1mL (过量)及适量的稀硫酸,水浴加热煮沸一段时间。(已知:Na2C2O4+2H2SO4+MnO2=MnSO4+2CO2↑+2H2O+Na2SO4)
步骤2. 然后用c2mol·L-1KMnO4标准溶液滴定剩余的Na2C2O4滴定至终点时消耗KMnO4标准溶液V2mL。(已知:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+10CO2↑+K2SO4+8H2O)
步骤2达滴定终点时判断依据是_____________;产品中MnO2的质量分数为ω(MnO2)=____________(列出计算的表达式即可)。
【答案】 4mol 2MnO2+4NaOH+O2![]() 2Na2MnO4+2H2O 煅烧后固体进行粉碎,适量增大水的量 适当提高浸取温度,充分搅拌 MnO4-(或NaMnO4) 取一小段pH试纸置于表面皿(点滴板上)中,用玻璃棒蘸取试液滴在pH试纸上,立刻与标准比色卡对照读出pH 2Na2MnO4+HCHO=2MnO2↓+Na2CO3+2NaOH 滴入最后一滴KMnO4溶液时,溶液呈浅红色且30s内不褪去
2Na2MnO4+2H2O 煅烧后固体进行粉碎,适量增大水的量 适当提高浸取温度,充分搅拌 MnO4-(或NaMnO4) 取一小段pH试纸置于表面皿(点滴板上)中,用玻璃棒蘸取试液滴在pH试纸上,立刻与标准比色卡对照读出pH 2Na2MnO4+HCHO=2MnO2↓+Na2CO3+2NaOH 滴入最后一滴KMnO4溶液时,溶液呈浅红色且30s内不褪去 ![]() ×100%
×100%
【解析】 (1)“煅烧氧化”时MnO![]() Na2MnO4锰由+2价变成+6价,失去电子为4e- ,1mol MnO煅烧完全失去电子的物质的量为4mol;MnO2煅烧反应的化学方程式为2MnO2+4NaOH+O2
Na2MnO4锰由+2价变成+6价,失去电子为4e- ,1mol MnO煅烧完全失去电子的物质的量为4mol;MnO2煅烧反应的化学方程式为2MnO2+4NaOH+O2![]() 2Na2MnO4+2H2O。
2Na2MnO4+2H2O。
(2)“浸取”时,为提高Na2MnO4的浸取率,就是增大化学反应速率,所以可采取的措施有:煅烧后固体进行粉碎,增大接触面积,适量增大水的量促进溶解,;适当提高浸取温度,加快化学反应速率,充分搅拌让物质充分迅速
(3)Na2MnO4中Mn的化合价为+6 ,MnO2中Mn的化合价为+4, Na2MnO4自身发生氧化还原反应,Mn的化合价为要升高,即发生MnO2 ![]() Na2MnO4
Na2MnO4 ![]() MnO4_,所以能生成MnO2,MnO4-(或NaMnO4)
MnO4_,所以能生成MnO2,MnO4-(或NaMnO4)
用pH试纸测定溶液pH的操作操作为(6). 取一小段pH试纸置于表面皿(点滴板上)中,用玻璃棒蘸取试液滴在pH试纸上,立刻与标准比色卡对照读出pH 。答案:MnO4-(或NaMnO4) 取一小段pH试纸置于表面皿(点滴板上)中,用玻璃棒蘸取试液滴在pH试纸上,立刻与标准比色卡对照读出pH 。
(4)由 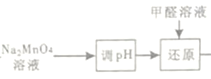 “还原指Na2MnO4与甲醛反应,发生反应的化学方程式为2Na2MnO4+HCHO=2MnO2↓+Na2CO3+2NaOH。
“还原指Na2MnO4与甲醛反应,发生反应的化学方程式为2Na2MnO4+HCHO=2MnO2↓+Na2CO3+2NaOH。
(5)达滴定终点时判断依据是:滴入最后一滴KMnO4溶液时,溶液呈浅红色且30s内不褪去。
由5H2C2O4+2KMnO4+3H2SO4=2MnSO4+10CO2↑+K2SO4+8H2O)
5 2
X c2v2 X=![]() = 2.5C2V2
= 2.5C2V2
由Na2C2O4+2H2SO4+MnO2=MnSO4+2CO2↑+2H2O+Na2SO4
1 1
C1V1-2.5C2V2 Y Y= (C1V1-2.5C2V2)mol
产品中MnO2的质量分数为m(MnO2)= (C1V1-2.5C2V2)mol![]() 87g/mol=87 (C1V1-2.5C2V2)/1000g
87g/mol=87 (C1V1-2.5C2V2)/1000g
产品中MnO2的质量分数为ω(MnO2)= 87(C1V1-2.5C2V2)/1000m![]() 100
100![]()


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
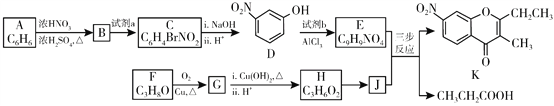
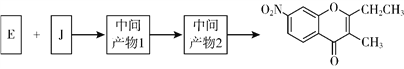
【题目】色酮类化合物K具有抗菌、降血脂等生理活性,其合成路线如下:
已知: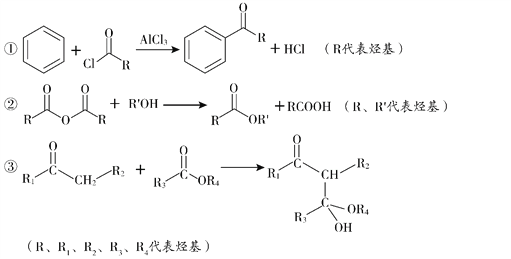
(1)A的结构简式是_________;根据系统命名法,F的名称是__________。
(2)B→C所需试剂a是__________;试剂b的结构简式是_________。
(3)C与足量的NaOH反应的化学方程式为__________。
(4)G与新制Cu(OH)2反应的化学方程式为__________。
(5)已知:①2H![]() J+H2O;②J的核磁共振氢谱只有两组峰。以E和J为原料合成K分为三步反应,写出有关化合物的结构简式:________。
J+H2O;②J的核磁共振氢谱只有两组峰。以E和J为原料合成K分为三步反应,写出有关化合物的结构简式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院用CO2合成了可降解塑料聚二氧化碳。下列相关说法,合理的是
A. 聚二氧化碳塑料是通过加聚反应制得的
B. 聚二氧化碳塑料与干冰互为同素异形体
C. 聚二氧化碳塑料与干冰都属于纯净物
D. 聚二氧化碳塑料的使用会产生“白色污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的变化,不能通过一步化学反应完成的是( )
A.Na2O2→Na2CO3B.Fe→FeCl2C.SiO2→H2SiO3D.Na2CO3→NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫、钴及其相关化合物用途非常广泛。回答下列问题:
(1)基态Co原子价电子轨道排布式为________,第四电离能I4(Co)<I4(Fe),其原因是_______;Co与Ca同周期且最外层电子数相同,单质钴的熔沸点均比钙大,其原因是_______.
(2)单质硫与熟石灰加热产物之一为CaS3,S32-的几何形状是_______,中心原子杂化方式是_______,与其互为等电子体的分子是_______ (举1例)。
(3)K和Na位于同主族,K2S的熔点为840℃,Na2S的熔点为950℃,前者熔点较低的原因是_______ 。
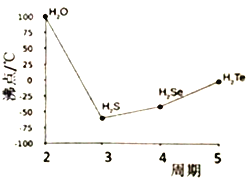
(4)S与O、Se、Te位于同一主族,它们的氢化物的沸点如右图所示,沸点按图像所示变为的原因是_______ 。
(5)钴的一种化合物晶胞结构如下图所示。

①已知A点的原子坐标参数为为(0,0,0),B点为(![]() ,0,
,0,![]() ),则C点的原子坐标参数为_____。
),则C点的原子坐标参数为_____。
②已知晶胞参数为a=0.5485nm,则该晶体的密度为_____g/cm3(列出计算表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算。
(1)含0.4 mol Al3+的Al2(SO4)3中所含的SO42-的物质的量是___________。
(2)___________molH2O2所含原子数与0.2molH3PO4所含原子数相等。
(3)某硫酸钠溶液中含有3.01×1022个Na+,则溶液中SO42-的物质的量是___________。
(4)0.7 mol H2O的质量为___________。
(5)483gNa2SO4·10H2O中所含的Na+的物质的量是___mol,所含H2O分子的数目是___个。
(6)质量相同的H2、NH3、SO2、O3四种气体中,含有分子数目最少的是____________。
(7)a个X原子的总质量为bg,则X的相对原子质量可以表示为___________
(8)现有mg某气体,它是三原子分子,其摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,请用以上符号及相应数字填写下列空格。
①该气体的物质的量为___________mol。
②该气体所含原子总数为___________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在总结元素化合物性质的过程中,发现化学反应无非是与以下几类物质的反应,并发现同一物质类别具有一定的通性。

(1)若A由短周期金属元素组成,其最外层电子数比电子层数少2。
①组成A的元素在周期表中的位置是_______。
②下列说法正确的是_______(填字母)。
a. A的金属性在短周期元素中最强
b. F可能使酚酞溶液变红
c. A能从D溶液中置换出活泼性较弱的金属单质
(2)若A在通常情况下为黄绿色气体。
①若B为一种金属单质,则A与B反应的方程式为_______。(任举一例)
②若C为NaOH溶液,则与0.5 mol A反应转移电子数为_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过用水溶解、过滤、蒸发等操作,可将下列各组混合物分离的是( )
A.硝酸钾、氢氧化钠B.氧化铜、二氧化锰
C.氯化钾、二氧化锰D.硫酸铜、氢氧化钡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com