
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7K2=5.6×10-11 |
| A. | NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)-c(OH-)=c(HCO3-)+2c(CO32-) | |
| B. | 25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)相等 | |
| C. | 25℃时,若同浓度的醋酸和氢氧化钠等体积混合,所得溶液pH=8,则 c(Na+)-c(CH3COO-)=9.9×10-7mol/L | |
| D. | 25℃时,0.1mol/L的各溶液的pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) |
分析 根据表中数据可知溶液酸性:CH3COOH>H2CO3>HCN>HCO3-,酸越弱,对应的盐水解程度越大,溶液碱性越强,结合溶液的电中性原则可解答该题.
解答 解:A.NaHCO3和Na2CO3混合溶液中存在电荷守恒,即c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故A正确;
B.根据pH=-lg[c(H+)]可知,25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)相等,故B正确;
C.若同浓度的醋酸和氢氧化钠等体积混合,溶液中存在:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),溶液pH=8,则c(Na+)-c(CH3COO-)=c(OH-)-c(H+)=1.0×10-6mol/L-1.0×10-8mol/L=9.9×10-7mol/L,故C正确;
D.根据表中数据可知溶液酸性:CH3COOH>H2CO3>HCN>HCO3-,酸越弱,对应的盐水解程度越大,溶液碱性越强,则25℃时,0.1mol/L的各溶液的pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa),故D错误;
故选D.
点评 本题考查酸碱混合的定性判断,离子浓度大小比较,盐类水解的应用,以及弱电解质的电离等知识,题目难度较大,注意酸性强弱的比较以及溶液守恒方法的应用.


科目:高中化学 来源: 题型:解答题
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大理石溶于醋酸中:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | |
| C. | MnO2与浓盐酸反应制Cl2:MnO2+4H++4Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl2↑+2H2O | |
| D. | 浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+$\frac{\underline{\;\;△\;\;}}{\;}$Fe3++3NO2↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
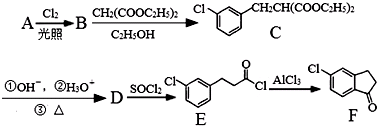
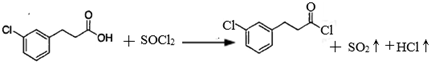 .
.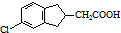 的合成路线流程图(注明反应条件).合成路线流程图示例如下:
的合成路线流程图(注明反应条件).合成路线流程图示例如下: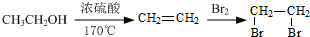
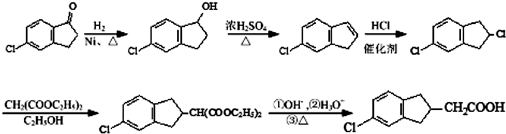 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W可能是氧元素,也可能是硫元素 | |
| B. | X元素氧化物对应的水化物一定是一种强酸 | |
| C. | Y元素原子次外层电子数与最外层电子敦之差为1 | |
| D. | Z可能是氯元素,也可能是钾元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子的半径:W>Z>Y>X | |
| B. | W和M形成的化合物是离子化合物 | |
| C. | 五种元素中只有X存在同素异形体 | |
| D. | 工业上采用电解W和Z形成的化合物制备W单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
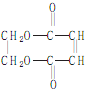 )的合成路线如下图:
)的合成路线如下图: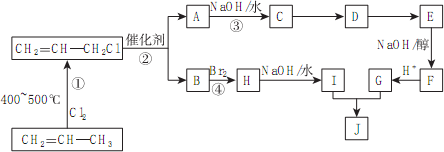
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com