
(12分)【化学一物质结构与性质】
根据物质结构与性质的关系,请回答下列问题:
(1)基态铬(Cr)原子的价电子排布式是________,这样排布使整个体系能量最低,原因是________。
(2)氨水中存在多种形式的氢键,其中与“氨极易溶于水”这种性质相关的氢键可表示为:_________。解释NH3分子中键角大于H2O中的键角的原因是_________ 。
(3)下列各项的比较中正确的是_________。
A.第一电离能:Mg>Al B.电负性:P>Ge
C.稳定性:AsH3>H2S D.金属性: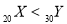
(4) Fe单质的晶体在不同温度下有两种堆积方式,晶胞
结构如图所示,体心立方晶胞和面心立方晶胞中实际含有的
Fe原子个数之比为_________。

(12分)
(1)3d54s1(2分) 3d、4s轨道上的电子均为半充满状态(2分)
(2)O—H…N N…H—O(2分) NH3分子中N原子采用sp3杂化后,N原子还有一对孤对电子,而H2O分子中O原子采用sp3杂化后,O原子有两对孤对电子,对成键电子的排斥作用更强、使键角更小。(2分)
(3)AB(2分)
(4)1:2(2分)
【解析】
试题分析:(1)Cr为24号元素,价电子排布式是3d54s1;根据洪特规则,轨道上排布的电子为全充满或半充满时,状态稳定,体系的能量低,Cr基态原子3d、4s轨道上的电子均为半充满状态,所以整个体系能量最低。
(2)氨极易溶于水,NH3分子与H2O分子间形成了氢键,可表示为:O—H…N N…H—O;N原子最外层有5个电子,与3个H原子形成N—H键后,N原子还有一对孤对电子,而H2O分子中,O原子与2个H原子形成O—H键后,还有两对孤对电子,对成键电子的排斥作用更强、使键角更小。
(3)A、Mg原子2s轨道排布2个电子,为全充满状态,所以第一电离能:Mg>Al,正确;B、根据元素周期表,电负性P > Si,Si > Ge,故P > Ge,正确;C、稳定性: H2S > PH3 >AsH3,错误;D、X质子数为20,为Ca, Y质子数为30,为Zn,活泼性Ca > Zn,错误。
(4)根据切割法,体心立方晶胞含Fe:8×1/8+1=2;面向立方晶胞含Fe:8×1/8+6×1/2=4,所以体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为:1:2。
考点:本题考查电子排布、氢键、元素周期律、晶胞的计算。


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源:2013-2014山西省6月高二化学期末测试卷(解析版) 题型:填空题
(8分)某有机物X的分子式为C4H8O
(1)若X能与NaOH溶液反应,则符合题意的X的结构式有种
(2)若X在酸性条件下与水反应,生成两种有机物Y和Z,Y在铜催化剂下被氧化为W,W能发生银镜反应
①W中所含官能团名称是
②符合题意的X结构有种
③若Y与Z含有相同的碳原子数,写出W与新制氢氧化铜反应的化学方程式。
查看答案和解析>>
科目:高中化学 来源:2013-2014山西大学附中高三第二学期5月理科综合化学试卷(解析版) 题型:选择题
下列离子方程式中正确的是
A.在少量Mg(OH)2悬浊液中滴加氯化铵浓溶液:Mg(OH)2+2NH4+=2NH3·H2O+Mg2+
B.双氧水中滴加2滴FeCl3溶液:Fe3++H2O2=Fe2++O2↑+2H+
C.双氧水加入稀硫酸和KI溶液: H2O2+2H++2I—= I2+ O2↑+2 H2O
D.向银氨溶液中加入盐酸:[Ag(NH3)2]++OH﹣+3H+=Ag++2NH4++H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省烟台市高三5月适应性测试一理综化学试卷(解析版) 题型:填空题
(12分)【化学——化学与技术】
海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)多级闪蒸法是目前“海水淡化”的主要技术。该法是在一定条件下将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水。由此可判断多级闪蒸法是 (填“物理变化” 或“化学变化”)。
(2)利用海水晒盐的原理是 ;分离食盐晶体后的母液中含有KCl、MgCl2,经过分离、提纯后,可用于 。
(3)“氯碱工业”利用电解饱和食盐水制得重要化工产品。在氯碱工业中,隔膜法电解(如图甲所示)工艺逐渐被离子交换膜电解(如图乙所示)技术取代。

①写出两电极的反应式:阳极 ,阴极 。
②石棉隔膜的作用是 。离子交换膜电解槽中⑥、⑦分别是 、 。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省烟台市高三5月适应性测试一理综化学试卷(解析版) 题型:选择题
NA表示阿伏伽德罗常数的值,下列叙述错误的是
A.2gD216O中含有的质子数、中子数、电子数均为NA
B.80g CuO和Cu2S的混合物含有铜原子数一定为NA
C.标准状况下,5.6L O2作氧化剂时转移电子数一定为NA
D.500mL 2mol·L-1Na2CO3溶液中含C微粒总数一定为NA
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省潍坊市高三4月模拟考试理综化学试卷(解析版) 题型:选择题
下列溶液中有关物质的浓度关系正确的是
A.c(NH4+)相等的NH4HCO3、NH4HSO4、NH4Cl溶液中:

B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液中:
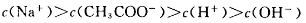
C.1.0mol Na2CO3 溶液中:
Na2CO3 溶液中:
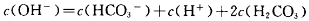
D.某二元弱酸的酸式盐NaHA溶液中:
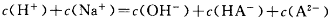
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省潍坊市下学期期中考试高二化学试卷(解析版) 题型:简答题
(10分) 下图中X是一种具有水果香味的合成香料,A是直链有机物,E与FeCl3溶液作用显紫色。
 请根据上述信息回答:
请根据上述信息回答:
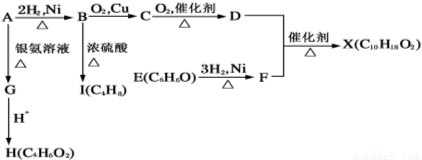
请回答下列问题:
 (1)H中含氧官能团的名称是 。B→I的反应类型为 。
(1)H中含氧官能团的名称是 。B→I的反应类型为 。
 (2)只用一种试剂鉴别D、E、H,该试剂是 。
(2)只用一种试剂鉴别D、E、H,该试剂是 。
 (3)H与J互为同分异构体,J在酸性条件下水解有乙酸生成,J的结构简式为 。
(3)H与J互为同分异构体,J在酸性条件下水解有乙酸生成,J的结构简式为 。
 (4)D和F反应生成X的化学方程式为 。
(4)D和F反应生成X的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省潍坊市下学期期中考试高二化学试卷(解析版) 题型:选择题
分子式为C5H11Cl的同分异构体共有(不考虑立体异构)
A.6种B.7种C.8种D.9种
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省淄博市高三二模理综化学试卷(解析版) 题型:填空题
(12分)【化学—化学与技术】
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸。
(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为 ,该反应在 中进行(填设备名称)。
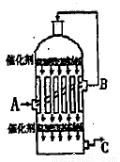
(2)为了有利于SO2转化为SO3,且能充分利用热能,采用了多层催化剂且有热交换器的 (填设备名称)中进行反应。在如图所示的装置中,C处流出的气体有 ;SO3进入 (填设备名称)用____ 吸收,得到浓硫酸或发烟硫酸。
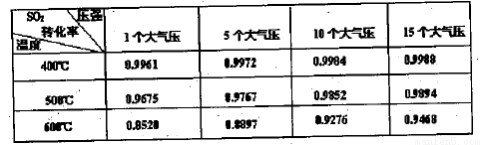
(3)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是 。
(4)吸收塔排出的尾气中SO2的含量如果超过500 L/L,就要加以处理后才能排出,处理方法之一是用氨水洗涤烟气脱硫,用方程式表示氨水洗涤吸收塔排除的尾气的化学方程式
L/L,就要加以处理后才能排出,处理方法之一是用氨水洗涤烟气脱硫,用方程式表示氨水洗涤吸收塔排除的尾气的化学方程式
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com