
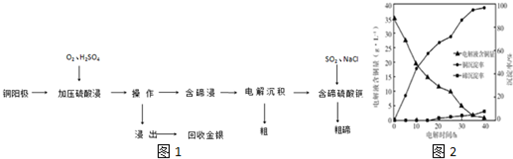
分析 (1)化学镀镍是在酸性环境下以NaH2PO2为还原剂(氧化生成NaH2PO3)使Ni2+还原,还原产物是Ni,据此书写离子反应;
(2)在电镀工业中,待镀金属做阴极,镀层金属做阳极,根据电镀池中电极反应式来回答;
(3)根据硫酸盐溶液中Cr3+的浓度对镀层厚度和覆盖范围的影响关系来分析原因;
(4)工业上控制反应温度的设备名称为热交换器,Cr2O72-具有很强的氧化性,可以和还原性的试剂之间发生反应,但是不能引进杂质离子;
(5)根据Ksp[Cr(OH)3]=5.0×10-31=c(Cr3+)•c3(OH-)来计算氢氧根离子浓度,根据Kw=c(H+)•c(OH-)来计算氢离子浓度,进而计算pH.
解答 解:(1)根据信息:化学镀镍是在酸性环境下以NaH2PO2为还原剂(氧化生成NaH2PO3)使Ni2+还原,还原产物是Ni,结合氧化还原反应知识,得到反应为:Ni2++H2PO2-+H2O=Ni+H2PO3-+2H+;故答案为:Ni2++H2PO2-+H2O=Ni+H2PO3-+2H+;
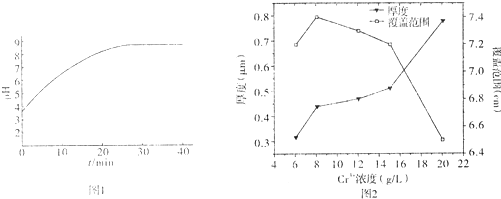
(2)在电镀工业中,待镀金属做阴极,镀层金属做阳极,根据电镀过程中阴极附近的pH与电镀时间的关系图,可以看出由于H+参与放电,导致溶液pH的变化,在阴极上,应该是金属阳离子得电子析出金属单质的过程,由于氢离子参与放电,所以镀层变薄且不均匀;故答案为:阴;H+参与放电;镀层变薄且不均匀;
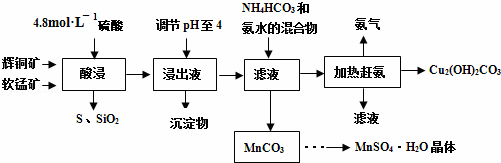
(3)根据硫酸盐溶液中Cr3+的浓度对镀层厚度和覆盖范围的影响关系,得到:Cr3+浓度增加会使镀层加厚,但浓度增加铬晶粒变大使覆盖范围变小,故答案为:Cr3+浓度增加会使镀层加厚,但浓度增加铬晶粒变大使覆盖范围变小;
(4)工业上控制反应温度的设备名称为热交换器;镀铬的过程中阳极会产生部分Cr2O72-,Cr2O72-具有很强的氧化性,可以和还原性双氧水、亚硫酸钠之间发生反应,但是C选项的硫酸亚铁会引进杂质离子,故选AB;
故答案为:热交换器;AB;
(5)含Cr3+为3.25g/L的电解液中,Cr3+的浓度是$\frac{\frac{3.25g}{52g/mol}}{1L}$=0.0625mol/L,根据Ksp[Cr(OH)3]=5.0×10-31=c(Cr3+)•c3(OH-),得到氢氧根离子浓度=$\root{3}{\frac{5.0×1{0}^{-31}}{0.0625}}$=2×10-10mol/L,Kw=c(H+)•c(OH-),c(H+)=$\frac{2×1{0}^{-14}}{2×1{0}^{-10}}$mol/L=10-4mol/L,所以pH=4,故答案为:4.
点评 本题涉及电解池的工作原理以及应用、难溶物的沉淀溶解平衡常数的计算等方面的知识,属于综合知识的考查,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
| 完全沉淀的pH | 9.7 | 3.7 | 6.4 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有大量Fe2+的溶液:Na+、SO42+、NH4+、Fe(CN)63- | |
| B. | 使甲基橙变红的溶液:NH4+、CH3COO一、SO42+、Mg2+ | |
| C. | 某无色溶液:OH一、K+、ClO一、Ba2+ | |
| D. | 含有大量NO3-的溶液:K+、I一、NH4+、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将5 mL 0.02 mol/L的H2SO4溶液与5 mL 0.02 mol/L NaOH溶液充分混合,若混合后溶液的体积为10 mL,则混合液的pH=2 | |
| B. | 某物质的溶液中由水电离的c(H+)=1×10-a mol/L,若a>7,则pH一定为14-a | |
| C. | pH相等的①CH3COONa ②C6H5ONa ③NaHCO3溶液,c(Na+)大小关系:①>③>② | |
| D. | CH3COONa溶液中加入少量KNO3固体后的碱性溶液一定有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com