
如图是利用二氧化硅制备硅及其化合物的流程,下列说法正确的是( )
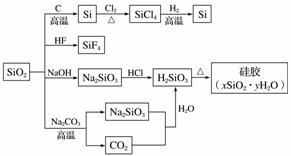
A.SiO2属于两性氧化物
B.盛放Na2CO3溶液的试剂瓶能用玻璃塞
C.硅胶吸水后可重复再生
D.图中所示转化反应都是氧化还原反应
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p3;④1s22s22p5。则下列有关比较中正确的是 ( )
A.第一电离能:④>③>②>①
B.原子半径:④>③>②>①
C.电负性:④>③>②>①
D.最高正化合价:④>①>③=②
查看答案和解析>>
科目:高中化学 来源: 题型:
)已知:C(s)+H2O(g)===CO(g)+H2(g) ΔH=a kJ·mol-1
2C(s)+O2(g)===2CO(g) ΔH=-220 kJ·mol-1
H—H、O===O和O—H键的键能分别为436、496和462 kJ·mol-1,则a为( )
A.-332 B.-118
C.+350 D.+130
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)2013年以来,全国很多地区都曾陷入严重的雾霾和污染天气中,冬季取暖排放的CO2、汽车尾气等都是形成雾霾的因素。
已知:①N2(g)+O2(g)===2NO(g)
ΔH=179.5 kJ·mol-1
②2NO(g)+O2(g)===2NO2(g)
ΔH=-112.3 kJ·mol-1
③2NO(g)+2CO(g)===N2(g)+2CO2(g)
ΔH=-759.8 kJ·mol-1
下图是在101 kPa,298 K条件下1 mol NO2和1 mol CO反应生成1 mol CO2和1 mol NO过程中能量变化的示意图。则a=________。

(2)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:CO2+H2O CO+H2+O2
CO+H2+O2
已知:

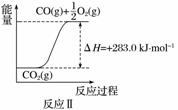
①反应Ⅱ是______反应(填“吸热”或“放热”),其原因是
________________________________________________________________________。
②反应A的热化学方程式是____________。
(3)一定条件下,在容积为3 L的密闭容器中反应:CO(g)+2H2(g)CH3OH(g)达到化学平衡状态。
根据题目有关信息,请在右下坐标图中标示出该化学反应过程的能量变化(标明信息)。

查看答案和解析>>
科目:高中化学 来源: 题型:
准状况下,将3.36 L CO2气体通入200 mL 1.00 mol·L-1 NaOH溶液中,充分反应后溶液中c(CO )与c(HCO
)与c(HCO )的比值为(不考虑CO
)的比值为(不考虑CO 、HCO
、HCO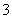 的水解)( )
的水解)( )
A.1∶1 B.1∶2 C.2∶1 D.1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
晶体硅(熔点1 410 ℃)是良好的半导体材料。由粗硅制纯硅过程如下:
Si(粗)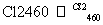 SiCl4
SiCl4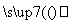 SiCl4(纯)
SiCl4(纯)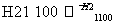 Si(纯)
Si(纯)
写出SiCl4的电子式:______________;在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式不正确的是( )
A.石英与烧碱反应:SiO2+2OH-===SiO +H2O
+H2O
B.硅与烧碱反应:Si+2OH-===SiO +H2↑
+H2↑
C.硅酸钠溶液中通入少量CO2:SiO +CO2+H2O===CO
+CO2+H2O===CO +H2SiO3↓
+H2SiO3↓
D.往水玻璃中加入盐酸:2H++SiO ===H2SiO3↓
===H2SiO3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
在Na+浓度为0.5 mol·L-1的某澄清溶液中,还可能含有下表中的若干种离子。
| 阳离子 | K+ Ag+ Mg2+ Ba2+ |
| 阴离子 | NO |
现取该溶液100 mL进行如下实验(气体体积均在标准状况下测定)。
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色沉淀并放出标准状况下0.56 L气体 |
| Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4 g |
| Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
请回答下列问题。
(1)实验Ⅰ能确定一定不存在的离子是________。
(2)实验Ⅰ中生成沉淀的离子方程式为________________________________________________________________
______________________________________________________________。
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)。
| 阴离子 | NO | CO | SiO | SO |
| c/(mol·L-1) |
(4)判断K+是否存在,若存在求其最小浓度,若不存在说明理由:_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
碘是原子半径较大的卤族元素,可能呈现金属性,下列事实能说明这个结论的是( )
A.已制得了IBr、ICl等卤素互化物
B.已经制得I2O5等碘的氧化物
C.已经制得I(NO3)3、I(ClO4)3·2H2O等含I3+的化合物
D.I2易溶于KI等碘化物溶液,形成I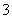
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com