
| A. | 配制盐酸溶液用量筒量取盐酸时,俯视刻度线 | |
| B. | NaOH溶解后未经冷却就注入容量瓶并定容至刻度线 | |
| C. | 称量11.7 g NaCl配制0.2 mol•L-1NaCl溶液1 000 mL时,砝码错放在左盘 | |
| D. | 配制盐酸溶液定容时,仰视容量瓶刻度线 |
分析 根据c=$\frac{n}{V}$分析操作对溶质的物质的量或对溶液的体积是否有影响判断,如果n偏大或V偏小,则所配制溶液浓度偏高,据此分析解答.
解答 解:A.用量筒量取盐酸时俯视刻度线,所取盐酸的体积偏少,溶质的质量偏少,导致配制溶液的浓度偏低,故A错误;
B.NaOH溶解后未经冷却就注入容量瓶并定容至刻度线,冷却后液面下降,溶液体积偏小,溶液浓度偏高,故B正确;
C.称量11.7gNaCl固体时用到游码,砝码错放左盘,会导致所称量的NaCl固体的质量偏小,所配制溶液的浓度偏低,故C错误;
D.配制盐酸溶液定容时,仰视容量瓶刻度线,导致溶液体积偏大,溶液浓度偏低,故D错误;
故选:B.
点评 本题考查配制一定物质的量浓度的溶液的误差分析,题目难度中等,注意根据c=$\frac{n}{V}$分析不当操作对n或V的影响.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 1:2 | C. | 1:4 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/K | 沸点/K | 分解温度/K |
| NH3 | 195.3 | 239.7 | 1073 |
| PH3 | 139.2 | 185.4 | 713.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述灼烧过程的尾气回收后可用来制硫酸 | |
| B. | 上述过程中,由6molCuFeS2制取6molCu时共消耗15molO2 | |
| C. | 在反应2Cu2O+Cu2S=6Cu+SO2↑中,氧化产物与还原产物的物质的量比1:6 | |
| D. | 在反应2Cu2O+Cu2S=6Cu+SO2↑中,只有Cu2O作氧化剂 |
查看答案和解析>>
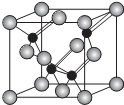
科目:高中化学 来源: 题型:解答题
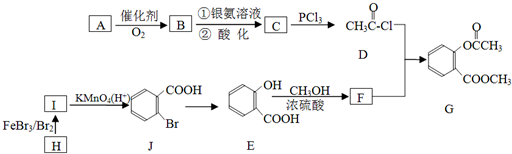
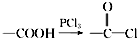 ,请回答以下问题:
,请回答以下问题: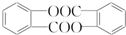 .
.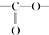 结构
结构 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 25℃时①10-3mol/L的盐酸;②pH=3的NH4Cl溶液;③pH=11的氨水中,水的电离程度为:②>③>① | |
| B. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) | |
| C. | pH=8.0的KHS溶液中,c(K+)>c(HS-)>c(OH-)>c(S2-)>c(H+) | |
| D. | 图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 误食重金属盐引起人体中毒,可喝大量的食盐水解毒 | |
| B. | 光纤通信使用的光缆主要成分是Si,太阳能电池使用的材料主要是SiO2 | |
| C. | 陶瓷、砖瓦、玻璃、水泥等,都是硅酸盐产品 | |
| D. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
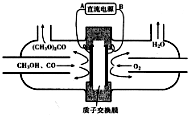
| A. | 外电源负极为A极 | |
| B. | 阳极的电极反应:2CH3OH+CO-2e-═(CH3O)2CO+2H+ | |
| C. | H+从右向左通过质子交换膜 | |
| D. | 电解槽中添加少量烧碱有利于导电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com