
| ||
| ||
| 8g |
| 32g/mol |
| 3 |
| 2 |
| 3 |
| 2 |


科目:高中化学 来源: 题型:
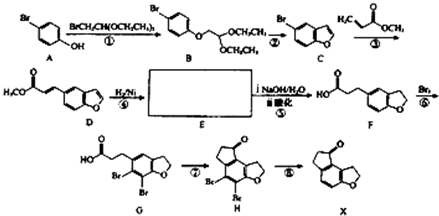
查看答案和解析>>
科目:高中化学 来源: 题型:
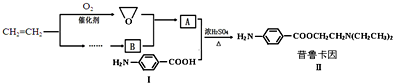
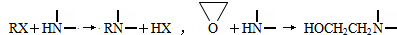
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、发生析氢腐蚀 |
| B、铁粉作阴极发生氧化反应 |
| C、含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) |
| D、可以吸热,从而降低温度,起保鲜糕点的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
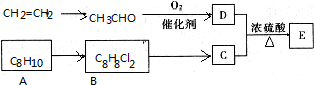
查看答案和解析>>
科目:高中化学 来源: 题型:
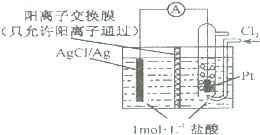
| A、正极反应为Cl2-2e-=2Cl- |
| B、放电时H+从右侧经阳离子交换膜移向左侧 |
| C、电路中转移0.01 mole-时,交换膜左侧溶液中减少0.01 mol离子 |
| D、若用NaCl溶液代替盐酸,电池的总反应不会改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 金属离子 | 开始沉演的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 9.6 |
| Co2+ | 5.8 | 9.4 |
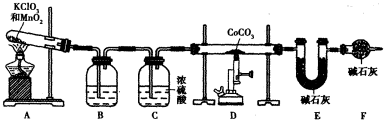
| x |
| y |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温高压 |
| 催化剂 |
 B.
B. C.
C. D.
D.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com