
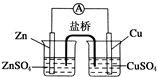
| A、锌电极发生还原反应,铜电极发生氧化反应 |
| B、盐桥中的阴离子向硫酸铜溶液中迁移 |
| C、电子从锌电极通过电流计流向铜电极 |
| D、铜电极上发生的电极反应为2H++2e-═H2↑ |


科目:高中化学 来源: 题型:
| A | B | C | D | |
| 强电解质 | HBr | FeCl3 | H3PO4 | Ca(OH)2 |
| 弱电解质 | HF | CH3COOH | BaSO4 | HI |
| 非电解质 | NH3 | Cu | H2O | C2H5OH |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合成氨反应需使用催化剂,说明催化剂可以促进该平衡向生成氨的方向移动 |
| B、常温下,将pH=10的氨水稀释,溶液中所有离子浓度都减小 |
| C、100 mL pH=3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明HA酸性比HB弱 |
| D、Fe2+与[Fe(CN)6]3-反应生成红色的铁氰化亚铁沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
A、该反应的化学方程式为CO+H2O
| |||
| B、恒温恒容下,增大压强,H2浓度一定减小 | |||
| C、升高温度,正反应速率增大,逆反应速率减小 | |||
| D、该反应的焓变为正值 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba(NO3)2、K2CO3、AgNO3、HNO3 |
| B、K2CO3、Ba(NO3)2、AgNO3、HNO3 |
| C、Ba(NO3)2、K2CO3、HNO3、AgNO3 |
| D、AgNO3、Ba(NO3)2、K2CO3、HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.500 mol/L |
| B、1.00 mol/L |
| C、2.00 mol/L |
| D、3.00 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等质量的Na2CO3和NaHCO3分别与足量盐酸反应,在相同条件下Na2CO3产生的CO2体积大 |
| B、等物质的量的Na2CO3和NaHCO3分别与相同浓度相同体积的盐酸反应,NaHCO3反应更剧烈 |
| C、向Na2CO3溶液中滴加酚酞溶液,溶液变红 |
| D、可用BaCl2溶液鉴别Na2CO3溶液和NaHCO3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com