
【题目】2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的 ΔH=—99kJ·mol-1.请回答下列问题:
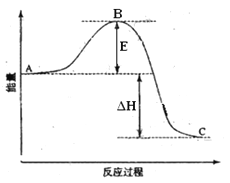
(1)图中A、C分别表示 、 ,
E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是
(2)图中△H= KJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:
、
;
(4)如果反应速率υ(SO2)为0.05 mol·L-1·min-1
,则υ(O2)= mol·L-1·min-1、
υ(SO3)= mol·L-1·min-1;
(5)已知单质硫的燃烧热为296 KJ·mol-1,求由S(s)生成3 molSO3(g)的△H= 。
【答案】(1)没有影响 降低
(2)-198 (3)SO2+V2O5===SO3+2VO2,4VO2+O2===2V2O5 (4)0.025 0.05
(5)-1 185 kJ/mol
【解析】
(1)由图像可知E代表活化能,和反应热无关。催化剂能降低反应的活化能,从而加快反应速率。
(2)1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol,而方程式中二氧化硫是2mol,所以ΔH=-198 kJ/mol.
(3)根据所给元素化合价的变化可写出反应的方程式,SO2+V2O5===SO3+2VO2,4VO2+O2===2V2O5 。
(4)因为化学反应速率之比是相应的化学计量数之比,所以v(O2)=0.025mol/(L·min)、v(SO3)=0.05mol/(L·min).
(5)考查盖斯定律的应用。由反应① 2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-198 kJ/mol和②S (s)+O2(g)
2SO3(g) ΔH=-198 kJ/mol和②S (s)+O2(g)![]() SO2(g) ΔH=-296 kJ/mol联立即①+②×2得2S(s)+3O2(g)
SO2(g) ΔH=-296 kJ/mol联立即①+②×2得2S(s)+3O2(g)![]() 2SO3(g) ΔH=-790 kJ/mol,所以由S(s)生成3 mol SO3(g)的ΔH=
2SO3(g) ΔH=-790 kJ/mol,所以由S(s)生成3 mol SO3(g)的ΔH=![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列各项中正确的是( )
A. 中所有碳原子可能在同一平面上
中所有碳原子可能在同一平面上
B.CH3CH2CHClCH3的命名为2-甲基-1-氯丙烷
C.乙烯、聚氯乙烯和苯分子中均含有碳碳双键
D.C4H8属于烯烃的同分异构体共有4种(含顺反异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作,说法正确的是
A. 配制一定物质的量浓度溶液时,容量瓶中有少量的水会导致溶液浓度偏低
B. 用盐酸标准溶液滴定未知浓度氨水,选用酚酞做指示剂的结果比甲基橙更准确
C. 测定硫酸铜晶体中结晶水含量时,加热后的坩埚应直接放置在石棉网上冷却
D. 测定中和热时,应迅速将酸、碱稀溶液在有保温措施的容器内混合、搅拌,记录最高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铜银合金(含少量铁)废料为原料回收银和铜的工艺流程如下:

下列说法正确的是
A. 粗铜溶于过量稀硝酸,过滤、低温干燥得纯铜
B. 电解时用粗银作阴极,硝酸银溶液为电解质溶液
C. 用稀硫酸处理渣料时主要发生了氧化还原反应
D. 从滤液B中可以提取绿矾(FeSO4·7H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物含有4个C,每个C原子都以键长相等的三条单键连接3个C,且整个结构中所有碳碳键之间的夹角都为60°,则下列说法不正确的是 ( )
A. 该有机物的分子式为C4H4B. 该有机物不存在
C. 该有机物的空间构型为正四面体D. 该有机物不属于苯的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,二氧化硫与氧气反应的热化学方程式为2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196 kJ·mol-1。现向5 L的恒容密闭容器中充入1.0 mol SO2和0.5 mol O2气体,反应一段时间后达到平衡,恢复到原温度,测得此过程中体系向外界共释放了78.4 kJ的热量。下列说法正确的是 ( )
2SO3(g) ΔH=-196 kJ·mol-1。现向5 L的恒容密闭容器中充入1.0 mol SO2和0.5 mol O2气体,反应一段时间后达到平衡,恢复到原温度,测得此过程中体系向外界共释放了78.4 kJ的热量。下列说法正确的是 ( )
A. 上述反应达到平衡时,二氧化硫和氧气的转化率都是20%
B. 上述反应达到平衡后,向容器中充入1.0 mol Ar,平衡正向移动
C. 起始时向容器中充入1.0 mol SO3,保持温度不变,达到平衡时共吸收19.6 kJ的热量
D. 起始时向容器中充入2.0 mol SO3、0.5 mol SO2和0.25 mol O2,反应达到平衡前v正<v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸为二元弱酸:H2C2O4![]() HC2O4﹣+ H+ Ka1 ; HC2O4﹣
HC2O4﹣+ H+ Ka1 ; HC2O4﹣![]() C2O42﹣+H+ Ka2,T℃常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4﹣、C2O42﹣三种,微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是
C2O42﹣+H+ Ka2,T℃常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4﹣、C2O42﹣三种,微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是

A. T℃时,lgKa2=-4.2
B. pH=1.2溶液中:c(K+)+c(H+)=c(OH﹣)+c(H2C2O4)
C. pH=2.7溶液中:![]()
D. 向pH=1.2的溶液中再加KOH溶液,将pH增大至4.2的过程中水的电离度一直增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组设计实验探究铜的常见化学性质,过程设计如下所示
(提出猜想)
问题1:在周期表中,铜与铝的位置很靠近,铜不如铝活泼,氢氧化铝具有两性。那么,氢氧化铜也具有两性吗?
问题2:铁和铜都有变价,一般情况下,正二价铁的稳定性小于正三价铁的稳定性。那么,正一价铜的稳定性也小于正二价铜的稳定性吗?
问题3:氧化铜具有氧化性,能被H2、CO还原。那么,氧化铜也能被氮的某种气态氢化物还原吗?
(实验探究)
I.解决问题1
(1)需用到的药品除1mol L-1 CuSO4溶液、稀硫酸外,还需_________(填试剂的化学式)溶液。
(2)用胆矾晶体配制1molL-1 CuSO4溶液250mL,选用的仪器除烧杯、托盘天平、药匙、玻璃棒、胶头滴管、量简外,还有________(填仪器名称)。
(3)为达到实验目的,你认为应进行哪些相关实验?
实验内容和步骤:①_________;②_______________。
Ⅱ.解决问题2
取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到80~100℃时得到黑色固体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜;取适量红色氧化亚铜粉末于洁浄试管中,加入过量的稀硫酸(或盐酸),得到蓝色溶液,同时观察到试管底部还有红色固体存在。根据以上实验现象回答冋题:
(1)写出氧化亚铜与稀硫酸(或盐酸)反应的离子方程式:_____________。
(2)从实验Ⅱ可得出的结论是_______________________。
Ⅲ.解决问题3
设计如下装置(夹持装置未画出):

当氮的某种气态氢化物(X)缓缓通过灼热的氧化铜时,观察到氧化铜由黑色变成了红色,无水CuSO4变成了蓝色,生成物中还有一种无污染的单质气体Y;将X通入灼热的CuO燃烧管完全反应后,消耗0.01molX,测得B装置增重0.36g,并收集到0.28g单质气体Y。
(1)X气体的摩尔质量是_________________。
(2)C装置中发生反应的化学方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在容积为 10L 的密闭容器中,1molX 和 1molY 进行如下反应:2X(g)+Y(g)![]() Z(g) 经 60s 达到平衡,生成 0.3molZ,下列说法正确的是
Z(g) 经 60s 达到平衡,生成 0.3molZ,下列说法正确的是
A. 以 X 浓度变化表示的反应速率为 0.001mol/(L·s)
B. 将容器容积变为 20L,Z 的平衡浓度为原来的 1/2
C. 若增大压强,则正反应速率增大,逆反应速率减小
D. 若升高温度,X 的体积分数增大,则该反应的ΔH >0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com