
下列有关化学用语表示正确的是( )
A.过氧化钠的电子式:
B.质子数为35、中子数为45的溴原子: Br
Br
C.硫离子的结构示意图: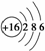
D.间二甲苯的结构简式: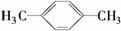
科目:高中化学 来源: 题型:
中华人民共和国国家标准(GB27602011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
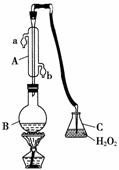
图1
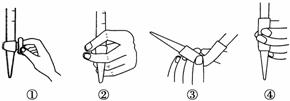
图2
(1)仪器A的名称是______,水通入A的进口为________。
(2)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为________________________________。
(3)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的________;若滴定终点时溶液的pH=8.8,则选择的指示剂为________;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)____________(①=10 mL,②=40 mL,③<10 mL,④>40 mL)。
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为________g·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
标准状况下将2.24 L CO2缓慢通入100 mL 1.5 mol·L-1的NaOH溶液中(溶液体积变化忽略不计),充分反应后,下列关系正确的是(双选)( )
A.c(CO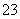 )<c(HCO
)<c(HCO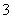 )
)
B.c(CO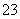 )+c(HCO
)+c(HCO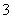 )=1 mol·L-1
)=1 mol·L-1
C.c(H+)>c(OH-)
D.c(Na+)+c(H+)=2c(CO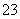 )+c(HCO
)+c(HCO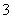 )+c(OH-)
)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于胶体的性质及应用的叙述正确的是(双选)( )
A.明矾能水解生成Al(OH)3胶体,可用作净水剂
B.将饱和的FeCl3溶液加热煮沸的方法制取氢氧化铁胶体
C.葡萄糖溶液和淀粉溶液的本质区别是能否发生丁达尔效应
D.提纯胶体用的渗析原理与从悬浊液过滤获取沉淀的原理相似
查看答案和解析>>
科目:高中化学 来源: 题型:
下列变化中,前者是物理变化,后者是化学变化,且都有明显颜色变化的是( )
A.打开盛装NO的集气瓶;冷却NO2气体
B.用冰水混合物冷却SO3气体;加热氯化铵晶体
C.木炭吸附NO2气体;将氯气通入品红溶液中
D.向酚酞溶液中加入Na2O2;向FeCl3溶液中滴加KSCN溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
请订正下面的错误。
(1)硫在足量氧气中燃烧:2S+3O2===2SO3。
________________________________________________________________________。
(2)AlCl3溶液呈酸性的原因:Al3++3H2O===Al(OH)3↓+3H+。
________________________________________________________________________。
(3)NaOH溶液与稀硫酸反应的离子方程式:2H++2OH-===2H2O。
________________________________________________________________________。
(4)工业合成氨反应:N2+3H2 2NH3。
2NH3。
________________________________________________________________________。
(5)工业上用氧化铝为原料制备金属铝:2Al2O3 4Al+3O2↑。
4Al+3O2↑。
________________________________________________________________________。
(6)NH4Cl溶液和NaOH溶液加热反应:NH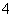 +OH-NH3·H2O。
+OH-NH3·H2O。
________________________________________________________________________。
(7)钢铁吸氧腐蚀,正极的电极反应:O2+2H2O===4OH-+4e-。
________________________________________________________________________。
(8)实验室制取氯气的离子方程式:MnO2+4HCl===MnCl2+Cl2↑+2H2O。
________________________________________________________________________。
(9)铜与浓硝酸反应:Cu+4HNO3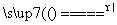 Cu(NO3)2+2NO2↑+2H2O。
Cu(NO3)2+2NO2↑+2H2O。
________________________________________________________________________。
(10)1 g肼气体燃烧生成氮气和水蒸气,放出热量16.7 kJ。反应的热化学方程式:N2H4+O2===N2+2H2O
ΔH=+16.7 kJ。
________________________________________________________________________。
(11)用惰性电极电解硫酸铜溶液的离子方程式:
2Cu2++4OH-===2Cu+O2↑+2H2O。
________________________________________________________________________。
(12)Ba(OH)2溶液与稀硫酸反应的离子方程式:
Ba2++OH-+H++SO ===BaSO4↓+H2O。
===BaSO4↓+H2O。
________________________________________________________________________。
(13)铝—海水电池的负极反应式:Al-3e-+4OH-===AlO +2H2O。
+2H2O。
________________________________________________________________________。
(14)碳酸氢钠在水中电离:NaHCO3Na++H++CO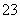 。
。
________________________________________________________________________。
(15)HCO 的水解方程式:HCO
的水解方程式:HCO +H2OH3O++CO
+H2OH3O++CO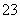 。
。
________________________________________________________________________。
(16)NaHSO4熔化时电离方程式:NaHSO4===Na++H++SO 。
。
________________________________________________________________________。
(17)NH4Cl溶液呈酸性的原因:NH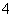 +H2ONH4OH+H+。
+H2ONH4OH+H+。
________________________________________________________________________。
(18)铜与浓硫酸反应:Cu+2H2SO4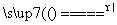 CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
________________________________________________________________________。
(19)NH4Cl固体和消石灰加热制NH3:2NH4Cl+Ca(OH)2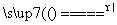 CaCl2+2NH3↑+H2O。
CaCl2+2NH3↑+H2O。
________________________________________________________________________。
(20)实验室制Cl2:4HCl(浓)+MnO2===MnCl2+Cl2↑+2H2O。
________________________________________________________________________。
(21)实验室利用H2O2分解制O2:2H2O2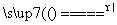 2H2O+O2↑。
2H2O+O2↑。
________________________________________________________________________。
(22)1 g氢气在足量氧气中燃烧生成液态水时,放出热量142.9 kJ,热化学方程式可表示为
 H2(g)+
H2(g)+ O2(g)
O2(g)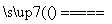
 H2O(l) ΔH=-142.9 kJ。
H2O(l) ΔH=-142.9 kJ。
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下面关于硅的叙述牛,正确的是 ( )
A.硅的非金属性比碳强,只有在高温下才能跟氢气起化合反应
B.硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位
C.硅的化学性质不活泼,在自然界中可以以游离态存在
D.硅在电子工业中是重要的半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验过程中,始终无明显现象的是 ( )
A.NO2通入FeSO4溶液中
B.CO2通入CaCl2溶液中
C.NH3通入A1Cl3溶液中
D.SO2通入已酸化的Ba(NO3)2溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com