
| … | E | A | B | ||
| C | … | D |
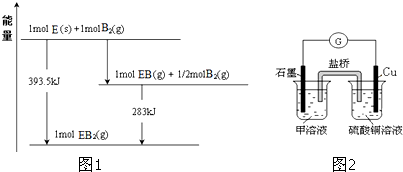
| 7 |
| 14 |
| 16 |
| 16 |
| 7 |
| 14 |
| 16 |
| 16 |
| 1 |
| 2 |


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
| A、碱性氧化物 七氧化二锰 Mn2O7 |
| B、酸性氧化物 干冰 CO |
| C、酸 硫酸 H2S |
| D、盐 纯碱 Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 实验结论 |
| ①将混合物溶于水,得到无色透明溶液 | 原混合物肯定无 |
| ②取少量上述溶液两份,其中一份加入BaCl2溶液,立即产生白色沉淀,再加入稀硝酸,沉淀不溶解 | 原混合物肯定有 |
| ③在另一份溶液中加入NaOH溶液,也产生白色沉淀 | 原混合物肯定有 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究.
溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究.查看答案和解析>>
科目:高中化学 来源: 题型:
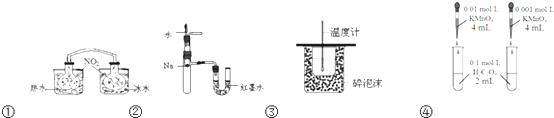
| A、装置①依据两容器内气体颜色变化,判断反应2NO2(g)?N2O4(g)平衡移动的方向 |
| B、装置②依据U管两边液面的高低判断Na和水反应的热效应 |
| C、装置③测定中和热 |
| D、装置④依据褪色快慢比较浓度对反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入盐酸酸化,将可能出现的沉淀过滤后,再加入Ba(NO3)2溶液 |
| B、先加入HNO3溶液酸化,再加入Ba(NO3)2溶液 |
| C、加入盐酸酸化的Ba Cl2溶液 |
| D、加入盐酸酸化,将可能出现的沉淀过滤后,再加入Ba Cl2溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com