
| A组物质 | 熔点/K | B组物质 | 熔点/K |
| NaCl | 1 074 | Na | 317 |
| KCl | 1 049 | Mg | 923 |
| CsCl | 918 | Al | 933 |
分析 A组物质活泼金属与活泼非金属元素一般形成离子键;B组物质金属单质是由金属键形成的金属晶体;根据元素在周期表中的位置判断价电子数;同周期从左到右阳离子半径依次减小,由此分析解答.
解答 解:活泼金属与活泼非金属元素一般形成离子键,则NaCl、KCl、CsCl均是由离子键构成的离子晶体,离子半径由大到小的顺序是Cs+>K+>Na+,所以粒子之间的作用力由大到小的顺序是NaCl>KCl>CsCl;金属单质是由金属键形成的金属晶体,主族元素的价电子数等于其族序数,则Na的价电子数为1,Mg的价电子数为2,Al的价电子数为3,故价电子数由少到多的顺序是Na<Mg<Al;同周期从左到右阳离子半径依次减小,则粒子半径由大到小的顺序是Na+>Mg2+>Al3+,金属键强度由小到大的顺序为Na<Mg<Al,故答案为:离子;离子键;NaCl>KCl>CsCl;金属;Na<Mg<Al;Na+>Mg2+>Al3+;Na<Mg<Al.
点评 本题考查了化学键、晶体、离子半径大小比较,题目难度不大,注意把握微粒半径大小比较方法.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 酸 | 电离常数K |
| HX | 9×10-7 |
| HY | 9×10-6 |
| HZ | 1×10-2 |
| A. | 三种酸的强弱关系:HX>HY>HZ | |
| B. | 反应HZ+Y -=HY+Z -能够发生 | |
| C. | 相同温度下,0.1mol/L的NaX、NaY、NaZ溶液,NaZ溶液pH最大 | |
| D. | 相同温度下,1mol/L HX溶液的电离常数大于0.1mol/L HX |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
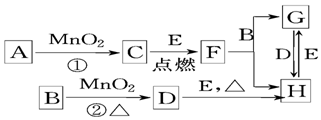
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol HCl气体所含H+数目为NA | |
| B. | 1 mol CO2气体含有的C═O键数为NA | |
| C. | 4.6 g分子式为C2H6O的有机物,所含C-H键数目一定为0.5NA | |
| D. | 1 mol Na2O2所含的阴阳离子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=1 | |
| B. | B的转化率为80% | |
| C. | 2min内A的平均反应速率为0.3 mol•(L•min)-1 | |
| D. | 若混合气体的密度不变,也不能明该反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na2O2+2CO2═2Na2CO3+O2,所以2Na2O2+2SO2═2Na2SO3+O2 | |
| B. | 电解熔融NaCl可以得到单质钠,所以电解熔融AlCl3也能得到单质铝 | |
| C. | CH4的空间构型是正四面体,所以CH3Cl的空间构型也是正四面体 | |
| D. | H2S的沸点比H2O低.所以PH3的沸点也比NH3低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
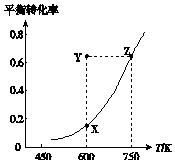 甲醇脱氢可制取甲醛CH3OH(g)?HCHO(g)+H2(g)△H,甲醇的平衡转化率随温度变化的曲线如图所示.下列有关说法正确的是( )
甲醇脱氢可制取甲醛CH3OH(g)?HCHO(g)+H2(g)△H,甲醇的平衡转化率随温度变化的曲线如图所示.下列有关说法正确的是( )| A. | △H<0 | B. | 从Y点到Z点可通过升高温度实现 | ||
| C. | 从Y点到X点可通过使用催化剂实现 | D. | 600 K时,Y点甲醇的v正<v逆 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com