
【题目】如右图,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是
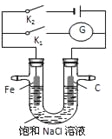
A. K1闭合,铁棒上发生的反应为2H++2e-=H2↑
B. K1闭合,石墨棒周围溶液pH逐渐升高
C. K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D. K2闭合,电路中通过0.002 NA个电子时,两极共产生0.001 mol气体
【答案】B
【解析】试题分析:A.若闭合K1,该装置没有外接电源,所以构成了原电池,较活泼的金属铁作负极,负极上铁失电子,Fe-2e-=Fe2+,故A错误;B.若闭合K1,该装置没有外接电源,所以构成了原电池;不活泼的石墨棒作正极,正极上氧气得电子生成氢氧根离子发生还原反应,电极反应式为2H2O+O2+4e-=4OH-,所以石墨棒周围溶液pH逐渐升高,故B正确;C.K2闭合,Fe与负极相连为阴极,铁棒不会被腐蚀,属于外加电源的阴极保护法,故C错误;
D.K2闭合,电路中通过0.002NA个电子时,阴极生成0.001mol氢气,阳极生成0.001mol氯气,两极共产生0.002mol气体,故D错误,故选B。


科目:高中化学 来源: 题型:
【题目】在密闭容器中,A与B反应生成C,其反应速率的关系为:vA=3vB、2vA=3vC,则该反应可表示为
A. 2A+ 6B =3C B. A+ 3B =2C C. 3A+ B =2C D. 2 A+ 3B =2C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、锂在元素周期表中具有特殊“对角线”关系,它们的性质相似。例如,它们的单质在过量氧气中燃烧时均只生成正常的氧化物等,下列关于锂的叙述不正确的是( )
A. Li2SO4能溶于水
B. LiOH是易溶于水、受热不分解的强碱
C. Li遇浓硫酸不产生“钝化”现象
D. Li2CO3受热分解,生成Li2O和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是前四周期原子序数依次增大的六种元素。A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,E元素原子的K、L层电子数之和等于其M、N层电子数之和,F被称为继铁、铝之后的第三金属,具有良好的生物亲和性,还可用于制造飞机、火箭、人造卫星、宇宙飞船等领域。请回答下列各题(涉及元素请用相应化学符号表示):
(1)B、C、D中第一电离最大的元素其基态原子有________种不同能量的电子。
(2)G分子中D原子的杂化方式为_______,F2+的基态价电子排布式为_________。
(3)BA3-离子的空间构型为________,与其互为等电子体的一种阳离子的电子式为__________。
(4)某化合物晶胞结构如图所示,E2+的最近且等距的D2-有_________个。KIO3晶体是一种性能良好的非线性光学材料,具有与右图相似的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,K与O间的最短距离为______nm。
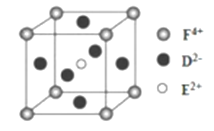
(5)用高能射线照射液态H时,一个H分子能释放出一个电子,同时产生一种阳离子。释放出来的电子可以被若干H分子形成的“网”捕获,你认为H分子间能形成“网”的原因________________。且由H分子释放出电子时产生的该种阳离子具有较强的氧化性,试写出该阳离子与S02的水溶液反应离子方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】特斯拉全电动汽车使用的是钴酸锂电池,其工作原理如下图,A极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式LixC6+Li1-xCoO2![]() C6+LiCoO2。下列说法不正确的是
C6+LiCoO2。下列说法不正确的是

A. 放电时电子从A极通过导线流向B极 B. 放电时A是负极
C. 放电时Li+从右向左定向迁移 D. 钴酸锂电池为二次电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂锰电池的体积小,性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。回答下列问题:
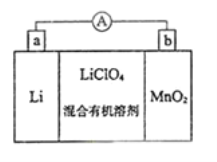
(1)外电路的电子流方向是由__________极流向__________极。(填字母a或b)
(2)电池正极反应式为________________________________________。
(3)是否可用水代替电池中的混合有机溶剂?__________(填“是”或“否”)原因是_______________。
(4)MnO2可与KOH和KClO4在高温条件下反应,生成K2MnO4,该反应的氧化产物和还原产物的物质的量比为________,K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2,该反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸型酸雨形成过程中,没有发生的化学方程式是( )
A. 2H2S + 3O2 =2SO2+2H2O B. SO3 + H2O = H2SO4
C. SO2 + H2O = H2SO3 D. 2H2SO3 + O2 = 2H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盖斯定律指出:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。物质A在一定条件下可发生一系列转化,由图判断下列关系错误的是
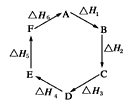
A. A→F,ΔH=-ΔH6
B. ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=1
C. C→F,|ΔH|=|ΔH1+ΔH2+ΔH6|
D. |ΔH1+ΔH2+ΔH3|=|ΔH4+ΔH5+ΔH6|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com