
【题目】下列说法中错误的是
A.推广使用新能源,可以减少二氧化碳等温室气体的排放
B.发电厂的燃煤在燃烧时加入适量石灰石,可减少二氧化硫排放
C.石油、煤、天然气均属于可再生的化石燃料
D.太阳能、氢能、风能属于清洁能源
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】用布氏漏斗和吸滤瓶接抽水泵过滤沉淀后,正确的操作是
A.先关水龙头,拔下抽滤瓶上的橡皮管,再取下布氏漏斗
B.先取下布氏漏斗,再关上水龙头
C.先将沉淀和滤纸一起取出,再关上水龙头
D.先拔下抽滤瓶上的橡皮管,关上水龙头,再取下布氏漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关镁的叙述正确的是( )
A. 工业制造的镁蒸气通常在H2或N2中冷却
B. 镁条燃烧引发的火灾可用CO2来扑灭
C. 镁在空气中燃烧的产物并不全是MgO
D. 镁制容器可用来贮存和运输浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
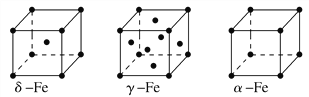
①NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点FeO________NiO(填“<”或“>”);
②铁有δ、γ、α三种同素异形体,各晶胞如下图,则δ、α两种晶胞中铁原子的配位数之比为________。
(2)元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为________;该晶体中,原子之间的强相互作用是________。
(3)某钙钛型复合氧化物如图1所示,以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe等时,这种化合物具有CMR效应。
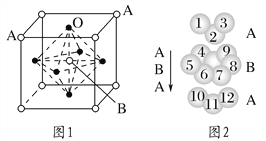
①用A、B、O表示这类特殊晶体的化学式:_________________________。
②已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3(x<0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁-铁磁、铁磁-顺磁及金属-半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为________。
③下列有关说法正确的是________。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧的第一电离能比氮的第一电离能大
C.锰的电负性为1.59,Cr的电负性为1.66,说明锰的金属性比铬强
D.铬的堆积方式与钾相同,则其堆积方式如图2所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关钠的叙述中错误的是( )
A. 电解法冶炼金属钠时,钠在阳极析出
B. 钠的化学性质非常活泼,钠元素只能以化合态存在于自然界
C. 钠的还原性很强,可以用来冶炼金属钛、锆、铌等
D. 钠的质地软,可用小刀切割
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.元素的第一电离能越大,其金属性一定越强
B.元素的第一电离能越小,其金属性一定越强
C.同主族元素的单质从上到下,金属性增强,熔点升高
D.金属单质与酸反应越容易,其元素的电负性越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不引入新杂质的情况下,分离FeCl3、KCl、BaSO4的混合物,应选用的一组试剂是
A. 水、氢氧化钾溶液、稀盐酸 B. 水、氢氧化钠溶液、稀盐酸
C. 水、硝酸银溶液、稀硝酸 D. 水、氢氧化钾溶液、稀硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W四种元素分别是元素周期表中三个连续短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子的最外层电子数之和。Y与X形成的分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍,试推断:
(1)X、Z两种元素的元素符号为:X________、Z________。
(2)由以上元素中两两形成的化合物中:溶于水显碱性的气态氢化物的电子式为________,它的共价键属于________(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为__________;含有极性共价键和非极性共价键的化合物的结构式为_________。
(3)由X、Y、Z所形成的常见离子化合物是________(写化学式),该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为_______________________________。
X与W形成的化合物与水反应时,水作________(填“氧化剂”或“还原剂”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com